
| A. | H2O2分解产生1molO2,转移的电子数为4NA | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数约为8 NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 标准状况下,2.24LCH4所含电子数为NA |
分析 A.双氧水中氧元素的化合价为-1价,生成1mol氧气转移了2mol电子;
B.钠离子最外层含有8个电子,1mol钠离子含有8个最外层电子;
C.二者的摩尔质量都是44g/mol,都为3原子分子;
D.甲烷分子中含有10个电子,标准状况下2.24L甲烷的物质的量为0.1mol,含有1mol电子.
解答 解:A.H2O2分解产生1molO2,转移了2mol电子,转移的电子数为2NA,故A错误;
B.1.00mol NaCl中含有1mol钠离子,1mol钠离子最外层含有含有8mol电子,则Na+的最外层电子总数约为8NA,故B正确;
C.4.4gCO2与N2O混合气体的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,0.1mol该混合气体中含有0.3mol原子,含有的原子总数为0.3NA,故C正确;
D.标准状况下,2.24LCH4的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,0.1mol甲烷分子中含有的核外电子的物质的量为:0.1mol×10=1mol,含有核外电子数为NA,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
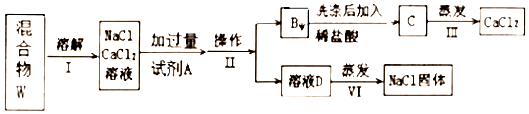
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、CO32- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 0.1 mol/L的NaNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| D. | 含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
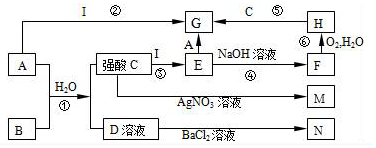
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中各原子最外层都一定满足8电子结构 | |
| B. | BaO2晶体中阳离子与阴离子数目之比为1:2 | |
| C. | H2O是一种非常稳定的化合物,这是由氢键所致 | |
| D. | 在反应2Na2O2+2H2O═4NaOH+O2↑中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是
A.氧化钙溶于水 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.碳酸钙受热分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com