
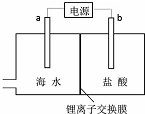
 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示?下列说法不正确的是( )| A. | a连接电源的正极 | |
| B. | Li+的移动方向是从海水进入到盐酸中 | |
| C. | 一段时间后,b电极附近溶液的pH降低 | |
| D. | 电解过程中还可能获得有经济价值的副产物氢气和氯气 |
分析 要想从海水中提取高浓度的锂盐,则锂离子应从海水进入到盐酸中,依据电解池工作原理,阳离子移向阴极,可知b为阴极与电源负极相连,a为阳极与电源正极相连;电解池阳极海水中的氯离子放电生成氯气,阴极上盐酸中的氢离子失去电子发生还原反应生成氢气,据此解答.
解答 解:A.要想从海水中提取高浓度的锂盐,则锂离子应从海水进入到盐酸中,依据电解池工作原理,阳离子移向阴极,可知b为阴极与电源负极相连,a为阳极与电源正极相连,故A正确;
B.电解池中阳离子移向阴极,b电极为阴极,所以Li+的移动方向是从海水进入到盐酸中,故B正确;
C.b电极为阴极,阴极上氢离子放电,氢离子浓度减小,pH值增大,故C错误;
D.电解池阳极海水中的氯离子放电生成氯气,阴极上盐酸中的氢离子得到电子发生还原反应生成氢气,故D正确;
故选:C.
点评 本题考查了电解原理,明确电解池工作原理、准确判断电解池的阴阳极及发生的反应是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 糖类、蛋白质、合成橡胶都是高分子化合物 | |
| D. | 甲苯、乙烯、聚乙烯都能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
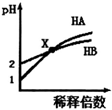
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 | |
| B. | Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | Na、K合金具有强还原性,可用于原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 着火时应立即灭火,一般的小火应用湿布、石棉布或沙子覆盖燃烧物,衣服着火时应迅速脱下衣服或用石棉布覆盖着火处 | |
| B. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 取5 mL 0.1 mol•L-1 KI溶液,滴加0.1 mol•L-1FeCl3溶液5~6滴,再加入2 mL CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变色 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 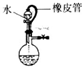 说明该装置气密性良好 | |
| B. | 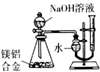 测定镁铝合金中铝的质量分数 | |
| C. | 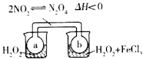 瓶中气体颜色变深,说明H202分解是吸热反应 | |
| D. | 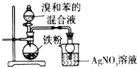 验证苯和溴发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
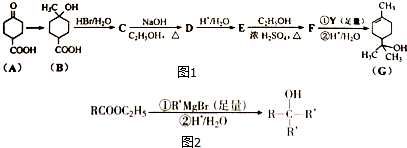
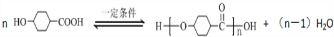 ;
; .
.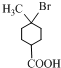 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )
元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )| A. | 质子数为11 | B. | 元素名称为钠 | ||
| C. | 元素符号为 Na | D. | 核外电子数为22.99 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com