
| A. | 4:1 | B. | 1:4 | C. | 3:1 | D. | 1:3 |
分析 设6mol/L HCl溶液和1mol HCl溶液的体积分别为xL和yL,根据溶液混合前后溶液中溶质的物质的量不变可知:2mol/L×(x+y)L=6mol/L×xL+1mol/L×yL,即可解得两溶液的体积比.
解答 解:设6mol/L HCl溶液和1mol HCl溶液的体积分别为xL和yL,根据溶液混合前后溶液中溶质的物质的量不变可知:2mol/L×(x+y)L=6mol/L×xL+1mol/L×yL,解得$\frac{x}{y}$=$\frac{1}{4}$,故选B.
点评 本题考查了溶液混合的有关计算,注意根据溶液在混合时,混合后溶液中溶质的物质的量和混合前两溶液中物质的物质的量的和相等,难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
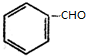 +H2(足量):
+H2(足量): +H2(足量)$\stackrel{催化剂}{→}$
+H2(足量)$\stackrel{催化剂}{→}$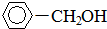 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应Cl2+2NaOH═NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是还原剂 | |
| B. | 在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂 | |
| C. | 在反应NaH+H2O═NaOH+H2↑中,H2既是氧化物又是还原产物 | |
| D. | 在反应H2S+H2SO4═S↓+SO2↑+2H2O中SO2是氧化产物,S是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式为C6H7O7 | |
| B. | 1 mol物质X可以和3 mol氢气发生加成 | |
| C. | X可以发生消去反应、取代反应等 | |
| D. | 1mol X分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Fe2++Br2═Fe3++Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2O2
+H2O2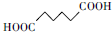 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10mL | B. | 小于10mL | C. | 大于10mL | D. | 等于5mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com