
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气: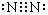 .
.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
分析 (1)CO2为共价化合物,碳和氧之间存在2对共用电子对,据此写出此分子的结构式;N2分子氮原子间存在氮氮三键,均满足8电子结构,据此写出电子式;
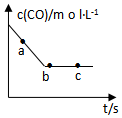
(2)①该反应中,CO浓度逐渐减小,直至达到平衡状态,根据图象可知,b、c点达到平衡状态,则a点反应速率一定大于b、c;
②bc点已经达到平衡状态,此时正逆反应速率相等,各组分的浓度不变,据此对各选项进行判断;
(3)①对照试验中需要控制变量,根据实验Ⅰ、Ⅱ中不同的反应条件进行判断实验目的;
②根据实验Ⅰ、Ⅲ的反应时间判断温度对该反应速率的影响
解答 解:(1)CO2的结构式为O=C=O,N2的电子式为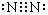 ;故答案为:O=C=O;
;故答案为:O=C=O; ;
;
(2)①该反应中,CO浓度逐渐减小,直至达到平衡状态,根据图象可知,b、c点达到平衡状态,a点还没有达到平衡状态,则a点反应速率一定大于b、c,即:υ(a)>υ(b)=υ(c),
故答案为:υ(a)>υ(b)=υ(c);
②根据图象曲线变化可知,b、c两点处于平衡状态,
A.化学反应速率与化学计量数成正比,则反应过程中NO、CO、CO2、N2的浓度比值始终为2:2:2:1,所以无法判断是否达到平衡状态,故A错误;
B.CO的浓度不再改变,说明正逆反应速率相等,已经达到平衡状态,故B正确;
C.反应消耗2molNO的同时消耗1molN2,证明正反应速率与逆反应速率相等,各组分浓度不再变化,达到了平衡状态,故C正确;
D.根据质量守恒定律可知容器中的气体质量始终不变,但混合气体的总物质的量不确定,达到平衡时才保持不变,故D错误;
故答案为:BC;
(3)①实验Ⅰ和实验Ⅱ的反应条件中,除了催化剂表面积大小不同以外,其它条件完全相同,说明实验目的是探究催化剂比表面积对反应速率的影响,
故答案为:探究催化剂比表面积对反应速率的影响;
②根据实验Ⅰ和实验Ⅲ可知,反应在不同温度下进行的,可见是探究温度对速率的影响,且升高温度后,达到平衡需要的时间少,说明升高温度,反应速率增大,则反应时间减小,
故答案为:温度;升高温度;增大.
点评 本题考查化学平衡及其影响、化学平衡、化学反应速率的计算、影响反应速率的因素等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力及化学实验能力,注意熟练掌握影响化学平衡、化学反应速率的因素,能够正确判断化学平衡状态.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: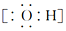 | B. | 乙酸的分子式:CH3COOH | ||
| C. | 溴乙烷的结构简式:CH2BrCH2Br | D. | 乙炔的实验式:CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
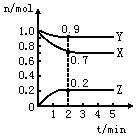 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的反应物总能量比产物总能量低QkJ | |
| B. | 1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 | |
| C. | 在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质可以把Y从其氢化物中置换出来 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 与H2化合时X单质比Y单质容易 | |
| D. | X原子的最外层电子数比Y原子的最外层电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com