
【题目】某同学进行体检时,发现在体检的血液化验单中,有如下一项内容:葡萄糖5.9×10-3mol/L。表示该体检指标的物理量是
A. 溶解度(S) B. 溶质的质量分数(w) C. 物质的量浓度(c) D. 摩尔质量(M)
科目:高中化学 来源: 题型:
【题目】下列离子能大量共存的是
A. 无色酚酞试液呈红色的溶液中:Na+ 、K+、SO![]() 、CO
、CO![]()
B. 无色透明的溶液中:Cu2+、K+、SO![]() 、NO
、NO![]()
C. 含有大量Ba(NO3)2的溶液中:Mg2+、NH、SO![]() 、Cl-
、Cl-
D. 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.聚氯乙烯塑料不可用来包装食品
B.缺碘易患大脖子病
C.由于淀粉在人体中会转化为氨基酸,因此每天都要摄入一定量的淀粉
D.皮肤被烫伤或受浓硝酸腐蚀时,细胞结构将受到破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列叙述正确的是
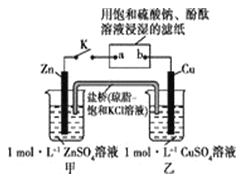
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(S![]() )增大
)增大
D.片刻后可观察到滤纸b点变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl26H2O)的过程为:
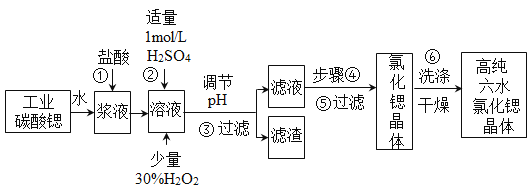
已知:Ⅰ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水;
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为__________________。
(2)操作②在酸性条件下,加入30% H2O2溶液的目的是: 。
(3)操作③将溶液的pH值由1调节至 (填选项);所得滤渣的主要成分是 (填化学式)。
A.1.5 B.4 C.7 D.9.7
(4)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 。
(5)操作⑥中,洗涤氯化锶晶体最好选用___________。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(6)若滤液中Ba2+ 浓度为1×10-5mol/L,则滤液中Sr2+物质的量浓度不大于 mol/L。
(已知:Ksp[SrSO4]=3.3×10-7,Ksp[BaSO4]=1.1×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理SO2的烟气,流程如下:
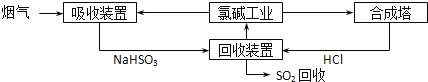
①“吸收装置”中发生反应的离子方程式_____________________。
②合成塔中每合成1mol气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式_____________。
③上述流程中循环利用的物质是____________________。
(2)方法二:利用FeCl3溶液氧化吸收烟气中SO2
①该反应的离子方程式________________________(反应a)。为验证该反应,同学们将SO2通入0.05mol/LFeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。关于红褐色液体,以下是同学们的分析推测与实验。
分析推测 | 实验步骤及现象 |
甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
②利用胶体的_________________(填性质)可以检验步骤I中是否得到了Fe(OH)3胶体。
③根据反应b说明步骤II中液体颜色变化的原因是______________________(用离子方程式及必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是( )
A. 淀粉和蛋白质都属于天然高分子化合物 B. 医用酒精中乙醇的浓度(体积分数)为75%
C. 用灼烧的方法可以区分蚕丝和人造纤维 D. 水可以用来分离溴苯和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
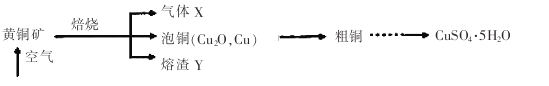
(1)下列装置不能用于吸收气体X的是_____________(填代号)。
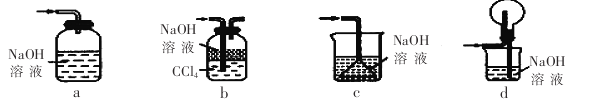
(2)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMn04溶液、NaOH溶液、氯水。 。
(3)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中HNO3与H2SO4的最佳物质的量之比为
(4)用滴定法测定所得产品中CuSO4.5H2O的含量,称取ag样品配成100 mL溶液,取出20.00 mL,用c mol.L-l滴定剂EDTA( H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂bmL。滴定反应如下:Cu2++ H2Y2-= CuY2-+ 2H+,则CuSO4·5H2O质量分数为_____________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。(填“偏高”、“偏低”和“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O、Br2。
(1)已知KBrO3在反应中得到电子,则该反应的氧化产物是________。
(2)0.2 mol KBrO3在反应中得到_____________ mol电子生成 Br2。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3> Br2 d.还原性:Br2>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的化学计量数填入下列方框中,并标出电子转移的方向和数目(用单线桥法):![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com