
【题目】NA为阿伏加德罗常数的值。下列说法正确的是 ![]()
![]()
A.0.1molL-1KClO溶液中ClO-的数目小于0.1NA
B.25℃时,100mlpH=8的氨水中NH4+的个数为9.9×10-8NA
C.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA
D.0.3molAgNO3受热完全分解![]() ,用排水法收集到气体的分子数为0.25NA
,用排水法收集到气体的分子数为0.25NA
【答案】B
【解析】
A. 溶液体积未知,无法计算次氯酸根离子个数;
B. 25℃时,100mL pH=8的氨水中存在电荷守恒:![]() ,据此计算NH4+的个数;
,据此计算NH4+的个数;
C. 34g质量分数为4%的H2O2水溶液中,双氧水中含有氧原子,溶剂水中也含有氧原子由此进行计算;
D. 将生成的气体NO2和O2通入水中后发生反应生成硝酸,根据AgNO3受热完全分解生成的气体中NO2和O2的物质的量计算出消耗氧气的物质的量,进一步计算收集到的气体的分子数。
A. 溶液体积未知,无法计算次氯酸根离子个数,A项错误;
B.25℃时,100mL pH=8的氨水中存在电荷守恒:c(NH4+)+c(H+)=c(OH-),则:c(NH4+)=c(OH-)- c(H+)=(10-6-10-8)mol/L,氨根离子个数为0.1L×(10-6-10-8)mol/L=9.9×10-8mol,以此100mlpH=8的氨水中NH4+的个数为9.9×10-8NA,B项正确;
C. 34g质量分数为4%的H2O2水溶液中,双氧水的物质的量为:![]() =0.04mol,双氧水中含有0.08mol氧原子,由于溶剂水中也含有氧原子,则该溶液中含氧原子数目大于0.08molNA, C项错误;
=0.04mol,双氧水中含有0.08mol氧原子,由于溶剂水中也含有氧原子,则该溶液中含氧原子数目大于0.08molNA, C项错误;
D. 将生成的气体NO2和O2通入水中后发生反应:![]() ,由于0.3molAgNO3受热完全分解生成的气体中NO2和O2的物质的量分别为0.3mol和 0.15mol,用排水法收集后,氧气消耗0.075mol,则剩余0.15mol-0.075mol=0.075mol,因此收集到的分子数为0.075NA个,D项错误。
,由于0.3molAgNO3受热完全分解生成的气体中NO2和O2的物质的量分别为0.3mol和 0.15mol,用排水法收集后,氧气消耗0.075mol,则剩余0.15mol-0.075mol=0.075mol,因此收集到的分子数为0.075NA个,D项错误。
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
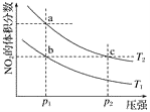
A. a、c两点的反应速率:a>cB. a、b两点的转化率:a<b
C. a、c两点气体的颜色:a深,c浅D. 由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡体系的各说法中不正确的是( )
A.在N2+3H2![]() 2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加
2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加
B.在CH3COOH ![]() CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动
CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动
C.纯水升温到100℃时,pH小于7,呈酸性
D.在盐酸中加入KCl晶体,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体形、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
Q | I1 | I2 | I3 | I4 | I5 | … |
电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有关问题:
(1)W原子的外围电子排布图为____________。
(2)化合物XYZ的结构式是______。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是__________(写分子式),原因是_________。
(4)RW3分子中的键角_______,RW32-的立体构型是_________形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。

(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)

①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。

(4)在容积固定的绝热容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-6molL-1
B.浓度均为0.1 molL-1的CuSO4和(NH4)2SO4的混合溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)
C.0.1 molL-1NaF溶液中加入NH4Cl至中性:c(HF)=c(NH3H2O)
D.0.100 molL-1的Na2S溶液中通入HCl气体,至c(Cl-)=0.100 molL-1(忽略溶液体积的变化及H2S的挥发):c(OH-)-c(H+)=c(HS-)-c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为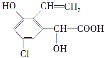 ,下列关于该有机物的说法中不正确的是
,下列关于该有机物的说法中不正确的是
A. 遇FeCl3溶液显紫色
B. 与足量的氢氧化钠溶液在一定条件下反应,最多消耗NaOH 3 mol
C. 能发生缩聚反应和加聚反应
D. 1 mol该有机物与浓溴水反应,最多消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )

A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com