
分析 ①根据Na2O2易与空气中的水及CO2反应,又过氧化钠为淡黄色的粉末状固体,所以应密封保存,不能保存在煤油中;
②根据能与BaCl2溶液产生不溶于稀硝酸的白色沉淀,可能为氯化银或者硫酸钡来分析;
解答 解:①Na2O2易与空气中的水及CO2反应,又过氧化钠为淡黄色的粉末状固体,所以应密封保存,不能保存在煤油中,故答案为:错误;
②某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该沉淀可能为氯化银或者硫酸钡,所以该溶液可能含有Ag+,或硫酸根离子,但二者不能同时存在,故答案为:正确;
点评 本题考查物质的保存与鉴别,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
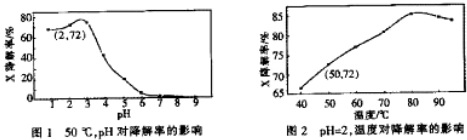
| A. | 温度为50℃,pH在3~6之间,X降解率随pH增大而减小 | |
| B. | pH=2,温度在40~80℃,X降解率温度升高而增大 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | pH=2,温度为50℃,10min内v(X)=1.44×10-4 mol•L-1 min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
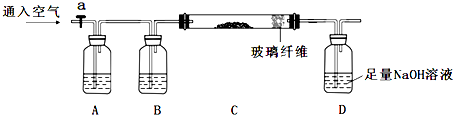
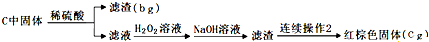
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
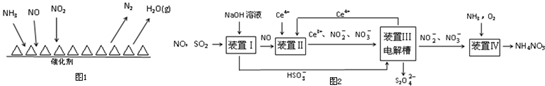
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
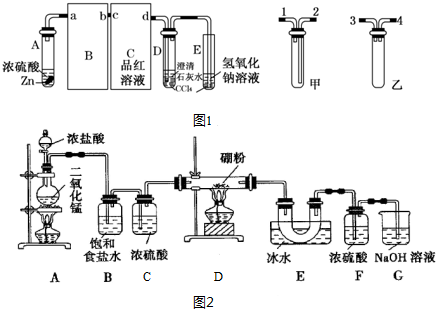
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | BeCl2 | C. | CO2 | D. | HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com