
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,有关说法正确的是
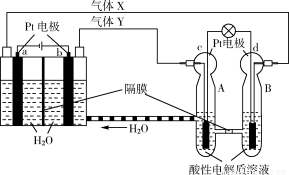
A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e- = 2H2O
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.使淀粉KI试纸变蓝(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:填空题
(14分) 2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
汽车尾气净化的主要原理为:2NO(g) + 2CO(g)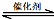 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
(1)同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式 。
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
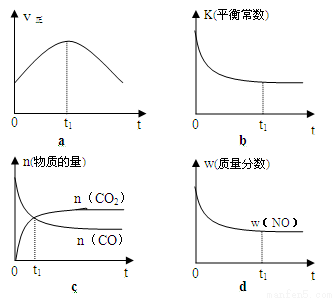
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率为 ;
②第5—6min,平衡移动的可能原因是 ;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)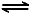 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(5)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(6)在一定条件下,也可以用H2可以处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
在55 ℃时,下列说法正确的是
A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变
B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L
C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42 -)>c(NH4+ ) >c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:填空题
(14分)已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=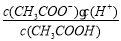 ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=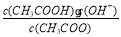 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是_______________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。如在25 ℃时碳酸的K1 草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显 性,而草酸氢钠溶液显酸性。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=_________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用____________(填一种实验方法)测定溶液浓度c′。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
关于下图中各装置的叙述不正确的是

A.装置①是中和滴定法测定硫酸的物质的量浓度
B.装置②中手捂烧瓶(橡胶管已被弹簧夹夹紧),发现导管中有液柱上升并保持稳定,则说明装置不漏气
C.装置③中X若为四氯化碳,可用于吸收氨气和氯化氢,并防止倒吸
D.装置④可用于检验溴乙烷发生消去反应得到的气体中含有乙烯(假定每个装置中吸收完全)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:填空题
(16分)制备氢气可利用碘硫热化学循环法,其原理示意图如下。

(1)已知:①2SO3(g) 2SO2 (g) + O2 (g) △H1
2SO2 (g) + O2 (g) △H1
②H2SO4(l) SO3(g) + H2O(l) △H2
SO3(g) + H2O(l) △H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3
2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。
I3─。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 。

②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
短周期非金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是

A.原子半径:甲<乙
B.非金属性:乙<丁
C.最高价氧化物的水化物的酸性:丙<丁
D.最外层电子数:丙>丁>戊
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:选择题
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是

A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com