
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
分析 A、元素的非金属性越强,则元素的电负性越大;
B、同周期从左到右第一电离能增大,但第IIA和第IIIA族、第VA族和第VIA反常;
C、同主族从上到下第一电离能依次减小;
D、电负性差值大的元素原子之间形成离子键.
解答 解:A、元素的非金属性越强,则元素的电负性越大,所以随原子序数的递增,第三周期元素的电负性逐渐增大,故A错误;
B、同周期从左到右第一电离能增大,但第IIA和第IIIA族、第VA族和第VIA反常,所以Mg的第一电离能比Al的第一电离能大,故B错误;
C、同主族从上到下第一电离能依次减小,则K、Na、Li的第一电离能逐渐增大,故C正确;
D、电负性大的元素易得电子,电负性小的元素易失电子,所以电负性差值大的元素原子之间容易得失电子,易形成离子键,故D错误;
故选C.
点评 本题考查了电负性、第一电离能的递变规律,难度不大,注意规律中的特殊性.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
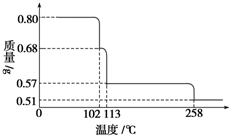 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水与固体CaO | B. | 稀盐酸与石灰石 | C. | 稀硝酸与铜片 | D. | 浓盐酸与MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: | |
| B. | CH4分子的比例模型 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 稀硝酸银溶液中滴加过量稀氨水,发生反应的离子方程式为Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
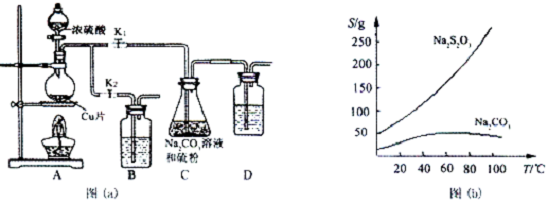
 硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2与 | B. | 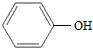 与 与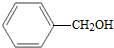 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com