
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.分析 (1)N的质子数为7,H的质子数为1,所以NH4+中质子数为11,电子数为10个,据此解答;同周期从左到右主族元素的原子半径逐渐减小;
(2)含有Na元素的淡黄色固体为过氧化钠;
(3)氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵;氯化铵中含铵根离子与氯离子之间的离子键,含N-H共价键;
(4)①D是纤维素水解的最终产物,则D为葡萄糖;
②Cu2O浓硝酸反应有红棕色气体生成,该红棕色气体为NO2,根据电子转移守恒可知有Cu(NO3)2生成,同时生成水;
③第二、三周期,第三、四周期,第ⅤⅠA主族元素原子序数差为8、18,据此确定Se的原子序数,根据化合价书写最高价氧化物对应的水化物化学式;元素周期表中 VIA族2~5周期元素单质的活泼性氧气>硫>硒>碲,单质越活泼生成1mol氢化物放出的热量越大,以此解答该题.
解答 解:(1)N的质子数为7,H的质子数为1,NH4+中含有10个电子,11个质子,与之相同的单核离子为钠离子,则M的原子结构示意图为 ;
;
同周期从左到右主族元素的原子半径逐渐减小,所以与Na同一周期的主族元素中原子半径最小的是Cl;
故答案为: ;Cl;
;Cl;
(2)含有Na元素的淡黄色固体为过氧化钠,其电子式 ;
;
故答案为: ;
;
(3)氯化铝和氨水反应生成氢氧化铝沉淀和氯化铵,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,NH4Cl中存在的化学键有离子键和共价键;
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;离子键;共价键;
(4)①D是纤维素水解的最终产物,则D为葡萄糖,分子式为C6H12O6,
故答案为:C6H12O6;
②Cu2O浓硝酸反应有红棕色气体生成,该红棕色气体为NO2,根据电子转移守恒可知有Cu(NO3)2生成,同时生成水,反应方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O,
故答案为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;
③Se与O同一主族,Se原子比O原子多两个电子层,即电荷数多26,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4;Se与O同主族,Se原子比O原子多两个电子层,该族2~5周期元素单质分别与H2反应生成的气态氢化物的稳定性为H2O>H2S>H2Se>H2Te,生成1molH2O、H2S、H2Se、H2Te的反应热分别为d、c、b、a,即生成1mol硒化氢反应热的是+29.7kJ;
故答案为:34;H2SeO4;b.
点评 本题考查结构位置关系的应用,题目涉及电子式、离子方程式、有机物的结构与性质、元素化合物的性质、元素周期律等,题目难度中等,注意基础知识的理解掌握,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl受热易分解,可用于实验室制氨气 | |
| B. | 液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 | |
| C. | NO2气体有毒,且可以和水反应,实验室多余的NO2气体用水吸收即可 | |
| D. | N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2=N2O4与N2O4=2NO2 | |
| B. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI与2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 | |
| C. | CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O | |
| D. | CaO+CO2=CaCO3与CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
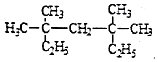 系统命名法为3,3,5,5-四甲基庚烷;
系统命名法为3,3,5,5-四甲基庚烷;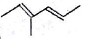 表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;
表示的有机物的结构简式是CH3CH=C(CH3)CH=CHCH3;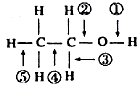
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
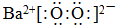 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型为酯化反应.
,反应类型为酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | C | |
| B |
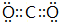 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达平衡后降低温度,混合气体平均相对分子质量减小 | |
| B. | 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率 | |
| C. | 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变 | |
| D. | 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com