
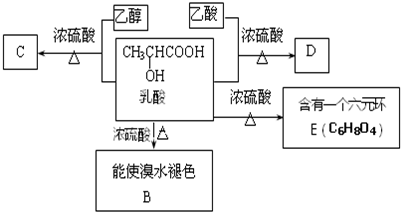
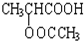 ;
;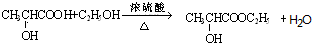 ;
;分析 乳酸与乙醇发生酯化反应得到C为 ,乳酸与乙酸发生酯化反应得到D为
,乳酸与乙酸发生酯化反应得到D为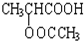 ,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为
,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为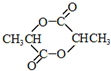 .
.
解答 解:乳酸与乙醇发生酯化反应得到C为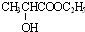 ,乳酸与乙酸发生酯化反应得到D为
,乳酸与乙酸发生酯化反应得到D为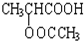 ,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为
,乳酸发生消去反应生成B为CH2=CHCOOH,2分子乳酸发生酯化反应形成环酯E为 .
.
(1)乳酸分子中含有的官能团是:羧基、羟基,故答案为:羧基、羟基;
(2)乳酸→D的反应类型是:酯化反应,故答案为:酯化反应;
(3)B的结构简式为CH2=CHCOOH,D的结构简式为: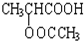 ,故答案为:CH2=CHCOOH;
,故答案为:CH2=CHCOOH;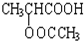 ;
;
(4)乳酸→C的化学方程式为: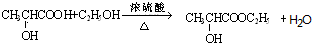 ,
,
故答案为: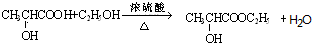 ;
;
(5)90g乳酸的物质的量为$\frac{90g}{90g/mol}$=1mol,羟基、羧基均与金属钠完全反应生成氢气,标况下生成氢气体积为:1mol×22.4L/mol=22.4L,故答案为:22.4.
点评 本题考查有机物推断,涉及醇、羧酸、酯之间的转化关系等,难度不大,熟练掌握官能团的性质与转化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 元素周期表中最右上角元素的非金属性最强 | |
| D. | 元素周期表有18个纵行,16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
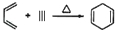 ,如果要合成
,如果要合成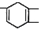 ,所用的起始原料可以是( )
,所用的起始原料可以是( )| A. | CH2=C(CH3)CH=CH2和CH≡C-CH2CH3 | B. | CH2=CHCH=CHCH3和CH3C≡CCH3 | ||
| C. | CH2=C(CH3)C(CH3)=CHCH3和CH≡CH | D. | CH2=C(CH3) C(CH3)=CH2和CH3C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)的原子核外有2个电子 | |
| B. | 1H与D是同一种原子 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 1H${\;}_{2}^{18}$O与D${\;}_{2}^{16}$O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
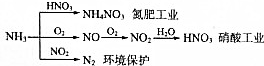
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com