
| A、标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | B、常温常压下,17g甲基(-14CH3)所含的电子数为9NA | C、同温同压下,1L NO和1L O2充分混合体积小于1.5L | D、pH=l的醋酸溶液100mL中氢离子数为0.01NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、探究金属钠的性质只需应用实验法即可 | B、研究未知物质的性质可按照观察→实验→预测→结论的顺序进行 | C、科学家提出的假说一定能成为科学理论 | D、使用模型有助于人们研究物质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | ||
| B、室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | ||
C、1L 0.5mol?L-1 的(NH4)2SO4溶液中含有的N
| ||
| D、标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L正丁烷所含共用电子对数为7NA | ||
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有氢原子的数目为0.8NA | ||
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA | ||
D、将CO2通过Na2O2使其增重a g时,反应中转移电子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个N2分子与0.5NA个H2分子所占的体积比一定是2:1 | B、相同物质的量的OH-和CH3+含有相同数目的电子 | C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | D、常温常压下,NO2与足量H2O反应生成0.1mol NO,则转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA | B、12g碳含有的电子数为4NA | C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源:2014~2015学年重庆市9月月考高一化学试卷(解析版) 题型:实验题
(14分)四氯化锡是无色液体,熔点-33"C,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
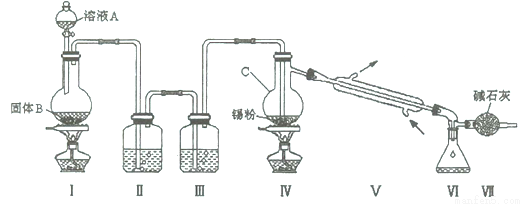
(1)仪器C的名称为 ;
(2)装置Ⅰ中发生反应的离子方程式为 ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com