

分析 由短周期元素的单质及其化合物的转化关系图可知,化合物E是形成酸雨的污染物之一,则E为SO2,A、B、C、D都是非金属单质,其中B、C、D在常温常压下是气体,则A为S,B为O2;化合物K是常用的氮肥,K为硫酸铵,所以F为氨气,则C、D分别为N2、H2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO,氨气与NaClO反应生成J,J由两种元素组成,它是火箭推进剂的成分之一,其相对分子质量为32,则J为N2H4;J与氧气反应生成C,C为氮气,以此解答该题.
解答 解:由短周期元素的单质及其化合物的转化关系图可知,化合物E是形成酸雨的污染物之一,则E为SO2,A、B、C、D都是非金属单质,其中B、C、D在常温常压下是气体,则A为S,B为O2;化合物K是常用的氮肥,K为硫酸铵,所以F为氨气,则C、D分别为N2、H2;化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得,则L为NaClO,氨气与NaClO反应生成J,J由两种元素组成,它是火箭推进剂的成分之一,其相对分子质量为32,则J为N2H4;J与氧气反应生成C,C为氮气,
(1)该反应为氨气与硫酸反应生成硫酸铵,化学反应为2NH3+H2SO4═(NH4)2SO4,故答案为:2NH3+H2SO4=(NH4)2SO4;
(2)由以上分析可知J为N2H4,故答案为:N2H4;
(3)L的溶液与化合物E反应,L为NaClO,E为SO2,在溶液中发生氧化还原反应生成氯化钠、硫酸钠,离子反应为ClO-+SO2+2OH-═Cl-+SO42-+H2O,
故答案为:ClO-+SO2+2OH-=Cl-+SO42-+H2O;
(4)如果H表示由两种无水盐组成的混合物,且其中组成S、N两单质的元素质量比为2:1,则应为(NH4)2SO3、NH4HSO3的混合物,
设(NH4)2SO3为xmol,NH4HSO3为ymol,
则32(x+y):14(2x+y)=2:1,
x:y=1:6,
则(NH4)2SO3、NH4HSO3的质量分数分别为$\frac{108}{108+6×95}×100%$=15.93%,1-15.93%=84.07%,
故答案为:(NH4)2SO3 为15.93%;NH4HSO3为84.07%.
点评 本题考查无机物的推断,为高频考点,侧重学生的分析、计算能力的考查,利用物质的性质及转化关系图来推断出各物质是解答本题的关键,(4)注意混合物的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
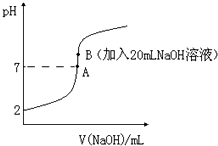 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
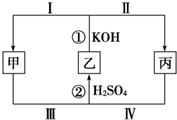 化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.
化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ④①③② | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com