
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、滤液中含有Cu2+ |
| B、反应中一定有气体产生 |
| C、滤出的固体可能是纯净物 |
| D、溶液的质量一定会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体化合物.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体化合物.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
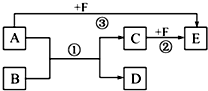 已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:
已知:A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
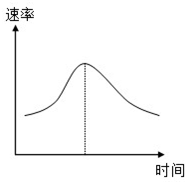 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:ClO3-+3HSO3-?Cl-+3H++3SO42-
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:ClO3-+3HSO3-?Cl-+3H++3SO42-查看答案和解析>>
科目:高中化学 来源: 题型:
 I、根据如图回答
I、根据如图回答 2SO3反应,
2SO3反应,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤、石油、天然气均为化石能源 |
| B、化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D、化石能源是可再生能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com