
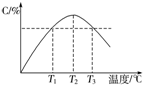
| A£® | 0”«5 min£¬CĪļÖŹµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.04 mol•L-1•min-1 | |
| B£® | Ķ¼ÖŠĪĀ¶ČT1Ź±µÄÕż·“Ó¦ĖŁĀŹµČÓŚĪĀ¶ČT3Ź±µÄÕż·“Ó¦ĖŁĀŹ | |
| C£® | øĆ·“Ó¦ĪĀ¶ČT2Ź±µÄĘ½ŗā³£Źż“óÓŚĪĀ¶ČT3Ź±µÄĘ½ŗā³£Źż | |
| D£® | Ķ¼ÖŠT2Ź±£¬ČōÖ»Ōö“óŃ¹Ē棬ŌņÕż”¢Äę·“Ó¦ĖŁĀŹ²»øıä |
·ÖĪö T2ĪĀ¶ČÖ®Ē°£¬ÉżøßĪĀ¶Č£¬CµÄŗ¬ĮæŌö“ó£¬T2ĪĀ¶ČÖ®ŗó£¬ÉżøßĪĀ¶Č£¬CµÄŗ¬Įæ¼õŠ”£¬¹ŹĒśĻßÉĻ×īøßµćĪŖĘ½ŗāµć£¬×īøßµćÖ®Ē°Ī““ļĘ½ŗā£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬×īøßµćÖ®ŗó£¬ø÷µćĪŖĘ½ŗāµć£¬ÉżøßĪĀ¶ČCµÄŗ¬Įæ½µµĶ£¬Ę½ŗāĻņÄę·“Ó¦£¬¹ŹÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£®
A£®ĄūÓĆĪļÖŹµÄĮæ±ä»ÆĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č¼ĘĖć”÷n£ØC£©£¬ŌŁøł¾Żv=$\frac{\frac{”÷n}{V}}{”÷t}$¼ĘĖćv£ØC£©£»
B£®ĪĀ¶ČŌ½øß·“Ó¦ĖŁĀŹŌ½æģ£»
C£®ĪĀ¶ČT2Ź±£¬·“Ó¦µ½“ļĘ½ŗā£¬ĪĀ¶ČÉżøßCµÄŗ¬Įæ½µµĶ£¬ĪĀ¶ČÉżøßĘ½ŗāĻņÄę·“Ó¦ŅĘ¶Æ£»
D£®·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬Ōö“óŃ¹Ēæ£¬Õż”¢Äę·“Ó¦ĖŁĀŹĶ¬µČ³Ģ¶ČŌö“ó£®
½ā“š ½ā£ŗĒśĻßÉĻ×īøßµćĪŖĘ½ŗāµć£¬×īøßµćÖ®Ē°Ī““ļĘ½ŗā£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬×īøßµćÖ®ŗó£¬ø÷µćĪŖĘ½ŗāµć£¬ÉżøßĪĀ¶ČCµÄŗ¬Įæ½µµĶ£¬Ę½ŗāĻņÄę·“Ó¦£¬¹ŹÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬
A.5minŗó·“Ó¦“ļµ½Ę½ŗāŹ±n£ØA£©ĪŖ0.4mol£¬Ōņ”÷n£ØA£©=1mol-0.4mol=0.6mol£¬¹Ź”÷n£ØC£©=2”÷n£ØA£©=1.2mol£¬¹Źv£ØC£©=$\frac{\frac{1.2mol}{2L}}{5min}$=0.12mol/£ØL•min£©£¬¹ŹA“ķĪó£»
B£®T1Ź±Ī“µ½“ļĘ½ŗāדĢ¬£¬T3Ź±“¦ÓŚĘ½ŗāדĢ¬£¬ĪĀ¶ČŌ½øß·“Ó¦ĖŁĀŹŌ½æģ£¬T1Ź±µÄÕż·“Ó¦ĖŁĀŹŠ”ÓŚT3Ź±µÄÕż·“Ó¦ĖŁĀŹ£¬¹ŹB“ķĪó£»
C£®ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦ŅĘ¶Æ£¬Ę½ŗā³£Źż½µµĶ£¬¹ŹT2Ź±µÄĘ½ŗā³£Źż“óÓŚT3Ź±µÄĘ½ŗā³£Źż£¬¹ŹCÕżČ·£»
D£®·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬Ōö“óŃ¹Ēæ£¬Õż”¢Äę·“Ó¦ĖŁĀŹĶ¬µČ³Ģ¶ČŌö“󣬹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāĶ¼Ļ󔢻Æѧ·“Ó¦ĖŁĀŹ¼ĘĖć¼°Ó°ĻģŅņĖŲ”¢»ÆŃ§Ę½ŗā³£ŹżµČ£¬ÄѶČÖŠµČ£¬ÅŠ¶Ļ×īøßµć¼°Ö®ŗóø÷µćĪŖĘ½ŗāµćŹĒ½āĢāµÄ¹Ų¼ü£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»ÆĒā | B£® | ŹÆÄ« | C£® | NaClČÜŅŗ | D£® | ÕįĢĒ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČÜŅŗµÄpHŌö“ó | B£® | NH3•H2OµÄµēĄėĘ½ŗā³£ŹżŌö“ó | ||
| C£® | NH3•H2OµÄµēĄė³Ģ¶ČŌö“ó | D£® | NH3•H2OČÜŅŗÖŠĖłÓŠĄė×ÓÅØ¶Č¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā

| A£® | ×ĘÉÕ²Ł×÷ŌŚÕō·¢ĆóÖŠ½ųŠŠ | |
| B£® | ČōXĪŖÉÕ¼ī£¬ŌņZĪŖ°±Ęų£¬³ĮµķaĪŖŗģ×ŲÉ«£¬æÉ×÷ŃÕĮĻ | |
| C£® | ČōXĪŖŃĪĖį£¬ŌņZĪŖCO2£¬ČÜŅŗ±ūÖ»ŗ¬NaClŗĶNa2CO3 | |
| D£® | Ķ¼Ź¾Ėł·¢ÉśµÄ·“Ó¦ĄąŠĶÓŠ£ŗ·Ö½ā·“Ó¦”¢ø“·Ö½ā·“Ó¦”¢Ńõ»Æ»¹Ō·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
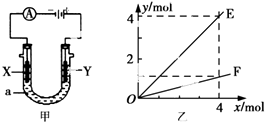
| A£® | Čō“Ė×°ÖĆÓĆÓŚµē½ā¾«Į¶Ķ£¬ŌņXĪŖ“æĶ”¢YĪŖ“ÖĶ£¬µē½āµÄČÜŅŗaæÉŅŌŹĒĮņĖįĶ»ņĀČ»ÆĶČÜŅŗ | |
| B£® | °“Ķ¼¼××°ÖĆÓƶčŠŌµē¼«µē½āAgNO3ČÜŅŗ£¬ČōĶ¼ŅŅŗį×ų±źx±ķŹ¾Į÷Čėµē¼«µÄµē×ÓµÄĪļÖŹµÄĮ棬ŌņEæɱķŹ¾·“Ӧɜ³ÉĻõĖįµÄĪļÖŹµÄĮ棬F±ķŹ¾µē½āÉś³ÉĘųĢåµÄĪļÖŹµÄĮæ | |
| C£® | °“Ķ¼¼××°ÖĆÓƶčŠŌµē¼«µē½āŅ»¶ØÅØ¶ČµÄĮņĖįĶČÜŅŗ£¬ĶصēŅ»¶ĪŹ±¼äŗ󣬼ÓČė0.5 molµÄĢ¼ĖįĶøÕŗĆ»Öø“µ½ĶصēĒ°µÄÅضČŗĶpH£¬Ōņµē½ā¹ż³ĢÖŠ×ŖŅʵĵē×ÓĪŖ2.0 mol | |
| D£® | ČōX”¢YĪŖ²¬µē¼«£¬aČÜŅŗĪŖ500 mL KClŗĶKNO3µÄ»ģŗĻŅŗ£¬¾¹żŅ»¶ĪŹ±¼äŗó£¬Į½¼«¾łµĆµ½±ź×¼×“æöĻĀ11.2 LĘųĢ壬ŌņŌ»ģŗĻŅŗÖŠKClµÄĪļÖŹµÄĮæÅضČÖĮÉŁĪŖ2.0 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ±½ŅŅĻ©ŹĒÖŲŅŖµÄ»ł“”ÓŠ»śŌĮĻ£®¹¤ŅµÖŠÓĆŅŅ±½£ØC6 H5-CH2 CH3£©ĪŖŌĮĻ£¬²ÉÓĆ“ß»ÆĶŃĒāµÄ·½·ØÖĘČ”±½ŅŅĻ©£ØC6 H5-CH=CH2£©µÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗ
±½ŅŅĻ©ŹĒÖŲŅŖµÄ»ł“”ÓŠ»śŌĮĻ£®¹¤ŅµÖŠÓĆŅŅ±½£ØC6 H5-CH2 CH3£©ĪŖŌĮĻ£¬²ÉÓĆ“ß»ÆĶŃĒāµÄ·½·ØÖĘČ”±½ŅŅĻ©£ØC6 H5-CH=CH2£©µÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗ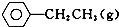 ?“߻ƼĮ
?“߻ƼĮ ØTCH2£Øg£©+H2£Øg£©
ØTCH2£Øg£©+H2£Øg£©| »Æѧ¼ü | C-H | C-C | C=C | H-H |
| ¼üÄÜ/kJ/mol | 412 | 348 | 612 | 436 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | RŹĒ¢õA×åŌŖĖŲ | B£® | n=2 | ||
| C£® | R ŹĒ×īĶā²ćÓŠ7øöµē×Ó£¬Ö»ÄÜŹĒĀČ | D£® | Rn-»¹ŌŠŌ“óÓŚ I- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 46gNO2ŗĶN2O4»ģŗĻĘųĢåÖŠŗ¬ÓŠŌ×Ó×ÜŹżĪŖ3NA | |
| B£® | 1molCl2Óė×ćĮæµÄĢś·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ2NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬Na2O2Óė×ćĮæH2O·“Ó¦£¬¹²Éś³É0.2molO2£¬×ŖŅʵē×ӵďżÄæĪŖ0.2NA | |
| D£® | 1 mol Na Óė×ćĮæO2 ·“Ó¦£¬Éś³ÉNa2OŗĶNa2O2µÄ»ģŗĻĪļ£¬ÄĘŹ§Č„NAøöµē×Ó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com