
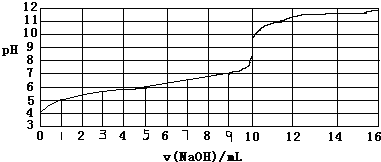
| A. | 此实验可以选用酚酞作指示剂 | |
| B. | 弱酸HA的浓度约为1×10-4mol/L | |
| C. | 根据已知条件,弱酸HA的电离常数(Ka)不能计算 | |
| D. | 当NaOH体积为9ml时,恰好完全中和反应 |
分析 A、氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
B、弱酸部分电离,弱酸的浓度大于溶液中氢离子的浓度;
C、依据电离平衡常数概念计算近似值;
D、当酸碱恰好反应时,滴定曲线会发生突变.
解答 解:A、氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,应选择酚酞作指示剂,故A正确;
B、弱酸部分电离,弱酸的浓度大于溶液中氢离子的浓度,所以弱酸HA的浓度大于1×10-4mol/L,故B错误;
C、由图象分析可知,c(H+)=1×10-4mol•L-1,但HA是弱酸,不完全电离,所以HA的浓度为大于1×10-4mol•L-1,一元弱酸电离程度近似为1%,则弱酸起始浓度为10-2mol/L,平衡常数=$\frac{1{0}^{-4}×1{0}^{-4}}{1{0}^{-2}}$=10-6,所以能计算弱酸HA的电离常数(Ka),故C错误;
D、当酸碱恰好反应时,滴定曲线会发生突变,由图象可知,当V=10mL,酸碱恰好中和,故D错误.
故选A.
点评 本题考查酸碱混合的定性判断和计算,题目难度中等,本题注意把握弱电解质的电离特点,注意酸碱中和滴定的实验原理.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg与N2完全反应,转移电子数都是0.3NA | |
| B. | 1mol白磷分子中含有P-P键数为1.5NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 在18g 18O2中含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 是强电解质,BaCO3 是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.05 mol•L-1醋酸溶液加水稀释时,c(H+)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{77}^{192}$Ir核外含有115个电子 | B. | Ir为非金属元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子数是115 | D. | ${\;}_{77}^{192}$Ir的质量数是77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

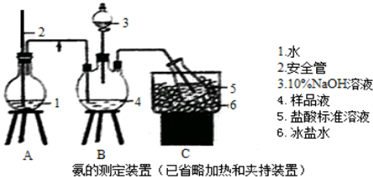
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 工业上以石油为原料生产乙烯 | |
| C. | 油脂不是酯 | |
| D. | 充分燃烧后只生成CO2和H2O的有机物就是烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
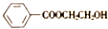 )和N(
)和N( )
)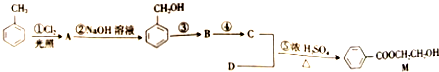
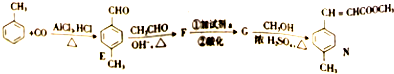
 )是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).
)是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).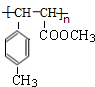 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com