
【题目】高分子化合物V ( )是人造棉的主要成分之一,合成路线如下:
)是人造棉的主要成分之一,合成路线如下:

已知:I.
II.![]()
III.
(R、R1、R2、R3 表示烃基)
(1)A的名称是________________________。
(2)试剂a是__________________________。
(3) F与A以物质的量之比1∶1发生反应生成六元环状化合物H,H的结构简式是_______。
(4)I的结构简式是________________________。
(5)G的结构简式是_______________________________;E与J反应生成M的化学方程式是_______________________________________________。
(6)M与C反应生成V的化学方程式是____________________________。
(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是_______(写一种即可)。
【答案】 乙烯 NaOH水溶液 ![]() HOOC(CH2)4COOH CH3CH2OH
HOOC(CH2)4COOH CH3CH2OH 
 CH3OOCCOOCH(CH3)2 或CH3OOCCOOCH2CH2CH3
CH3OOCCOOCH(CH3)2 或CH3OOCCOOCH2CH2CH3
【解析】A为乙烯,乙烯与溴发生加成反应生成B为BrCH2CH2Br,B在氢氧化钠水溶液、加热条件下发生水解反应生成C为HOCH2CH2OH,C发生氧化反应得到D为HOOC-COOH,D与乙醇发生酯化反应生成E为CH3CH2OOCCOOCH2CH3。M与乙二醇反应得到V,结合V的结构简式可知M为 ,结合信息Ⅲ可知J为CH3CH2OOC(CH2)4COOCH2CH3,故I为HOOC(CH2)4COOH,G为CH3CH2OH,H为
,结合信息Ⅲ可知J为CH3CH2OOC(CH2)4COOCH2CH3,故I为HOOC(CH2)4COOH,G为CH3CH2OH,H为![]() 。
。
(1)A的名称是乙烯;(2)BrCH2CH2Br在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,试剂a是:氢氧化钠水溶液;(3)1,3-丁二烯与乙烯以物质的量之比1:1发生反应生成六元环状化合物H的结构简式是![]() ;(4)由上述分析可知,I的结构简式是HOOC(CH2)4COOH;(5)G为乙醇,结构简式为CH3CH2OH,E与J反应生成M的化学方程式是
;(4)由上述分析可知,I的结构简式是HOOC(CH2)4COOH;(5)G为乙醇,结构简式为CH3CH2OH,E与J反应生成M的化学方程式是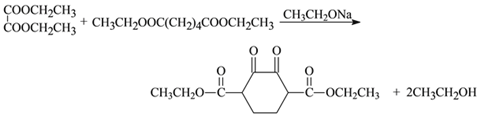 ;(6)M与C反应生成V的化学方程式是
;(6)M与C反应生成V的化学方程式是 ;(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是CH3OOCCOOCH(CH3)2 或CH3OOCCOOCH2CH2CH3。
;(7)E的同分异构体N也可以和J反应生成M,N可能的结构简式是CH3OOCCOOCH(CH3)2 或CH3OOCCOOCH2CH2CH3。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。
I.下列制氢方法最节能的是______(填字母序号)。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
II.科学家提出“绿色自由”构想,把空气中的CO2使用合适的催化剂可转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是______ (填字母序号)。
A.CO2和CH3OH的浓度相等 B.3v正(H2)=v逆(H2O)
C.容器内压强保持不变 D.H2的百分含量保持不变
E. 容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如右图,则上述CO2转化为甲醇的反应的△H______0(填“>”、“<”或“=”)。

(3) 300℃时,将CO2和H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(α)与体系总压强(P)的关系如右图所示。回答问题:

①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______(填字母序号)。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率增大
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
②B点平衡混合气体的平均摩尔质量为________(保留一位小数)。
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为: N2(g)+H2(g)=2NH3(g) △H<0
(1)右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)

A.t1→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4时改变的条件是________________。
进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L,则此时V正_____V逆 (填">"“<”或“=”)。
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物 的性质叙述正确的是
的性质叙述正确的是
A. 1mol该有机物最多可以与6mol H2发生反应
B. 1mol该有机物最多可以与3molNa发生反应
C. 1mol该有机物最多可以与3mol NaOH发生反应
D. 1mol该有机物最多可以与2mol NaHCO3发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项括号内为杂质,后面为除杂质操作,其中正确的是( )
A.乙酸乙酯(乙酸),加NaOH溶液、分液
B.福尔马林(乙酸),加Na2CO3溶液、分液
C.溴乙烷(乙醇),加水振荡、分液
D.苯(苯酚),加溴水振荡、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 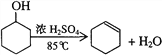
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
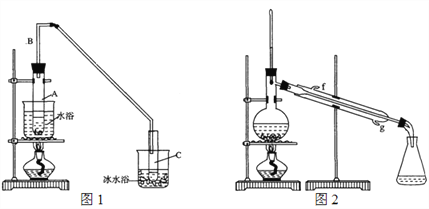
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面。下列关于苯的叙述正确的是( )
A. 分子式为C6H6B. 属于不饱和烃C. 能在空气中燃烧D. 无色无毒的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH与水反应化学方程式为NaH+H2O=NaOH+H2↑ 在该反应中H20是
A、是氧化剂
B、是还原剂
C、既是氧化剂又是还原剂
D、 既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的应用。下列生产、生活中的事例不涉及氧化还原反应的是
A. 金属冶炼 B. 燃放鞭炮
C. 食物腐败 D. 点制豆腐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com