
A.若生成H2O(l),则放出热量大于Q kJ B.若使用H2(l),则放出热量大于Q kJ
C.若使用O2(s),则放出热量大于Q kJ D.电解
科目:高中化学 来源: 题型:
2.0 g H2(g)在O2(g)中完全燃烧,生成H2O(g),放出热量Q kJ。则下列说法正确的是( )
A.若生成H2O(l),则放出热量大于Q kJ
B.若使用H2(l),则放出热量大于Q kJ
C.若使用O2(s),则放出热量大于Q kJ
D.电解90.0 g液态水,需要吸收Q kJ的热量
查看答案和解析>>
科目:高中化学 来源:2012届浙江省五校高三第一次联考化学试卷 题型:填空题
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 或"不能确定")
或"不能确定") CH3OH(g)+H2O
CH3OH(g)+H2O (g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
 据如下。下列说法正确的是
据如下。下列说法正确的是 | 容器 | 实验1 | 实验2 | 实验3 |
| 反应物投入量(始态) | 1mol CO2、3mol H2 | 1mol CH3OH、1mol H2O | 2mol CH3OH、2mol H2O |
| CH3OH的平衡浓度/mol·L-1 | C1 | C2 | C3 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ |
| 体系压强/Pa | P1 | P2 | P3 |
| 反应物转化率 | a1 | a2 | a3 |
 CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市高三上学期期末调研测试化学试卷 题型:填空题
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) + O2(g)
= H2O(g) △H=-241.8 kJ/mol
O2(g)
= H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
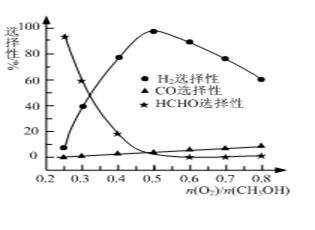
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2009一2010年度吉林一中下学期高一期中考试化学卷 题型:选择题
2.0 g H2(g)在O2(g)中完全燃烧,生成H2O(g),放出热量Q kJ。则下列说法正确
的是 ( )
A.若生成H2O(l),则放出热量大于Q kJ
B.若使用H2(l),则放出热量大于Q kJ
C.若使用O2(s),则放出热量大于Q kJ
D.电解90.0 g液态水,需要吸收Q kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com