二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式______.
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______.
(3)回收得到的SeO2的含量,可以通过下面的方法测定,测定的原理如下:反应①发生后产生的I2,I2的量在反应②中被滴定,淀粉为指示剂,以Na2S2O3溶液为标准溶液
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.2500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为______.
解:(1)利用题中信息可知Se与浓HNO
3反应,Se被氧化为+4价的H
2SeO
3,HNO
3还原为NO与NO
2,生成NO与NO
2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为
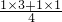
=1,故反应方程式为:Se+2HNO
3(浓)=H
2SeO
3+NO↑+NO
2↑,故答案为:Se+2HNO
3(浓)=H
2SeO
3+NO↑+NO
2↑;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以根据反应的方程式可知,SeO
2、H
2SO
4(浓)、SO
2的氧化性由强到弱的顺序是H
2SO
4(浓)>SeO
2>SO
2,故答案为:H
2SO
4(浓)>SeO
2>SO
2;
(3)根据反应的方程式可知SeO
2~2I
2~4Na
2S
2O
3,消耗的n(Na
2S
2O
3)=0.2000 mol/L×0.025L=0.005mol,根据关系式计算样品中n(SeO
2)=0.005mol×

=0.00125mol,故SeO
2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO
2的质量分数为
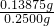
×100%=55.5%,故答案为:55.5%.
分析:(1)利用题中信息可知Se与浓HNO
3反应,Se被氧化为+4价的H
2SeO
3,HNO
3还原为NO与NO
2,利用电子守恒和限定条件(生成NO与NO
2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式;
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的,而还原剂的还原性强于还原产物的;
(3)根据反应的方程式可知,SeO
2~2I
2~4Na
2S
2O
3,根据n=cV计算消耗的n(Na
2S
2O
3),根据关系式计算样品中n(SeO
2),再根据m=nM计算SeO
2的质量,进而计算样品中SeO
2的质量分数.
点评:本题考查氧化还原反应的有关判断及计算等,难度中等,注意(3)中根据关系式的计算.

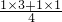 =1,故反应方程式为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑,故答案为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑;
=1,故反应方程式为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑,故答案为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑; =0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为
=0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为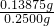 ×100%=55.5%,故答案为:55.5%.
×100%=55.5%,故答案为:55.5%.
