
| A. | CH3CH2Br→CH3CH2OH→CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br→CH2=CH2 $\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br→CH2=CH2 $\stackrel{Br_{2}}{→}$CH2BrCH2Br |
分析 溴乙烷含有溴原子,可在氢氧化钠水溶液中发生水解反应,在氢氧化钠醇溶液中发生消去反应,应先发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,要考虑到反应原理是否正确外,还要考虑到对环境是否造成污染,以及生产成本问题,以此解答该题.
解答 解:A.溴乙烷在氢氧化钠醇溶液加热条件下直接生成烯,原理复杂,故A不选;
B.溴乙烷与溴发生取代反应,不能制备纯净的1,2-二溴乙烷,故B不选;
C.溴乙烷与溴发生取代反应,不能制备纯净的1,2-二溴乙烷,故C不选;
D.溴乙烷在氢氧化钠醇溶液、加热条件下发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2二溴乙烷,原理正确,不存在其它副产物,故D选;
故选D.
点评 本题考查有机物的合成,为高考中的常见题型,属于中等难度的试题,有利于拓展学生的视野,开阔学生的思维,提高学生的学习效率,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱 和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生 变性 |
| B | 在CuSO4溶液中加入KI溶液,再 加入苯,振荡后静置 | 有白色沉淀生成,苯层 呈紫红色 | 白色沉淀可能 为CuI |
| C | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后, 滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2样品 已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的稳定性强于H2S | |
| B. | Cl元素最高正价为+7,而S元素最高正价为+6 | |
| C. | 将Cl2通入Na2S溶液中,产生黄色沉淀 | |
| D. | 单质与H2化合所需的反应条件,S比Cl2苛刻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化合物X的分子式是C16H11O4 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 化合物X可由 和 和  通过酯化反应得到 通过酯化反应得到 | |
| D. | 1 mol化合物X最多能与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
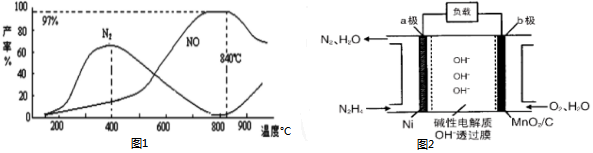
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在核磁共振氢谱中水杨酸与阿司匹林应该分别为6个吸收峰与8个吸收峰 | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代反应、加成反应、氧化反应和水解反应 | |
| D. | 1 mol阿司匹林最多可消耗3 mol NaOH或1 mol NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) |
| 密度/g•cm-3 | 0.789 | 1.595 | 0.71~0.76 | 4.93 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
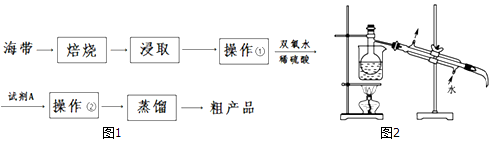
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com