
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中
H++S2-,若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气) + Y(气) = nZ(气) + 2W(气) 5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.02mol/(L·min)求:
(1)反应中Z气体的计量数n:
(2)反应在5 min末时,Y的转化率:
(3)前5 min以X浓度变化来表示的反应平均速率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法。已知:
① C(s)+ O2 (g) = CO2 (g) ΔH = -393.5 kJ·mol-1
② CO(g) + ![]() O2 (g) = CO2 (g) ΔH = -283.0 kJ·mol-1
O2 (g) = CO2 (g) ΔH = -283.0 kJ·mol-1
③ H2(g) + ![]() O2 (g) = H2O (g) ΔH = -241.8 kJ·mol-1
O2 (g) = H2O (g) ΔH = -241.8 kJ·mol-1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 ,该反应的化学平衡常数K随温度的升高将 (填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g) + H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/ mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/ mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向 (填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 。

②右图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的所有可能的条件是 。
(3)以CO为燃料制作燃料电池,电池的正极入O2和CO2,负极通入CO,电解质是熔融碳酸钠,工作时负极反应式为 ,若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下) L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6是一种优良的绝缘气体,分子结构中只存在S﹣F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.﹣1780kJ/mol B.﹣1220 kJ/mol C.﹣450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
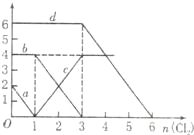
A.d曲线代表溶液中Br﹣变化情况
B.原溶液中FeI2的物质的量为2mol
C.原溶液中n(Fe2+):n(Br﹣)=2:3
D.当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池中, B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法错误的是( )
A.葡萄糖的分子式是C6H12O6
B.葡萄糖属于有机高分子化合物
C.葡萄糖是人体重要的能量来源
D.葡萄糖能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个电解池均为Pt为电极,且互相串联.甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液.通电一段时间后,测得甲池电极质量增加2.16g,乙池电极上析出0.24 g金属,则乙池中的溶质可能是( )
A.MgSO4 B.Al(NO3)3 C.CuSO4 D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH 溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)根据图示判断,下列说法正确的是

A. 当V(NaOH)="20" mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 欲使NaHA溶液呈中性,可以向其中加入酸或碱
D. 向NaHA溶液加入水的过程中,pH可能增大也可能减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com