
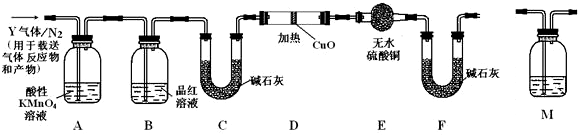
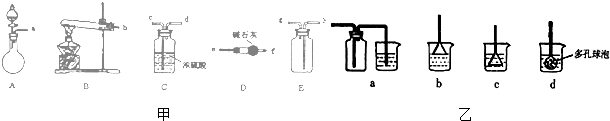
分析 (1)常温条件下,铁与浓硫酸能产生钝化现象;
(2)根据亚铁离子的性质选取试剂,亚铁离子有还原性,可用强氧化性的物质检验,且必须有明显的实验现象;
(3)二氧化硫能使品红溶液褪色,从而检验二氧化硫是否存在,空气中有水蒸汽会影响无水硫酸铜对水的检验;
(4)根据铁钉的成分分析,铁钉中的铁和碳在加热条件下都能与浓硫酸发生氧化还原反应;
(5)根据二氧化硫和二氧化碳的性质分析选择位置;
(6)根据氢气的性质分析,氢气具有还原性,能还原黑色的氧化铜而生成水,水能使白色的无水硫酸铜变蓝;碱石灰能吸收二氧化碳;
(7)计算出氢气的物质的量及生成水的质量,然后根据中学阶段质量的称量选择托盘天平,分度值是0.1g进行判断.
解答 解:(1)铁钉放入冷硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,
故答案为:铁钉表面被氧化;
(2)①亚铁离子能使酸性高锰酸钾褪色,溶液中已经有三价铁离子,选择a会造成干扰,b能检验三价铁离子的存在,选c生成两种沉淀,受氢氧化铁沉淀颜色的影响无法分辨,
故选d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol;
SO2 ~BaSO4
1mol 233g
n 2.33g
n=0.01mol
所以二氧化硫的体积分数为:$\frac{0.01mol}{0.015mol}$=66.7%,
故答案为:66.7%;
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,
故答案为:检验二氧化硫是否除尽;
(4)在加热时,铁钉中不仅铁和浓硫酸反应,碳也和浓硫酸反应生成生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2 ↑+2SO2↑+2H2O,
所以气体二氧化硫还含有二氧化碳,
故答案为:C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2 ↑+2SO2↑+2H2O;
(5)Q为二氧化碳,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,选择a或b受二氧化硫的影响无法判断二氧化碳的存在,选d时二氧化碳被碱石灰吸收,
故选C;
(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝色,同时有红色的铜单质生成,
故答案为:D中固体由黑色变红和E中固体由白变蓝;
(7)标况下28mL氢气的物质的量为:$\frac{0.028L}{22.4L/mol}$=0.00125mol,生成水的质量为:18g/mol×0.00125mol=0.0225g,即D、E的质量差小于0.1g,而中学阶段质量的称量选择托盘天平,分度值是0.1g,无法精确称量出D或E的差量,所以不能用通过托盘天平称量质量差的方法测量氢气含量,
故答案为:否,用托盘天平无法称量D或E的差量.
点评 本题考查了浓硫酸的性质、实验方案的设计与评价,题目难度中等,注意掌握性质实验方案设计的原则及评价方法,明确常见气体的性质及检验方法,(7)为易错点,需要通过计算进行判断.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式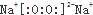 | B. | CO2的电子式: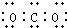 | ||
| C. | 12753I和12953I2互为同位素 | D. | 硫离子的结构示意图: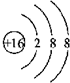 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
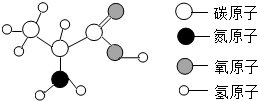 蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )
蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )| A. | 它是由四种元素组成的有机高分子化合物 | |
| B. | 每个丙氨酸分子中含有13个原子核 | |
| C. | 丙氨酸分子中含有3个碳原子 | |
| D. | 丙氨酸分子中氮、氧元素的质量比为1:2 |
查看答案和解析>>
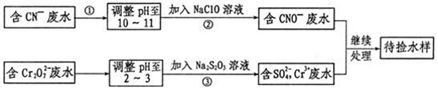
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=0.5,a=8 | B. | x=0.5,a=10 | C. | x=1.5,a=8 | D. | x=1.5,a=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
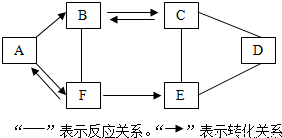
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
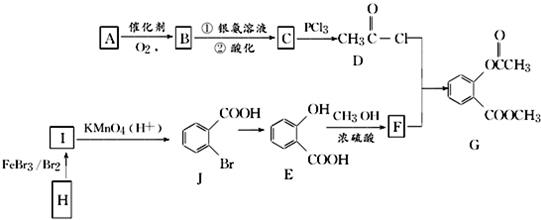
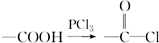
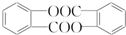 .
.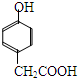 .
.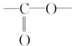 结构
结构查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com