
| A. | 热水漏斗 | B. | 布氏漏斗 | C. | 分液漏斗 | D. | 滴定管 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性:C>N | B. | 酸性:HClO4>H2CO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑦ | B. | ①②③④⑥ | C. | ①④⑦⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是指电解熔融氯化钠制取氯气的方法 | |
| B. | 氯碱工业只能得到氯气和氢氧化钠两种有价值的产品 | |
| C. | 实验室模拟氯碱工业制取氯气后所得溶液呈碱性 | |
| D. | 实验室模拟氯碱工业所得氯气不能直接排放,应用澄清石灰水吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| B. | 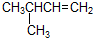 2-甲基-3-丁烯 2-甲基-3-丁烯 | |
| C. | 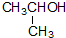 1-甲基乙醇 1-甲基乙醇 | |
| D. | 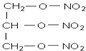 硝化甘油 硝化甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | AgCl | Ag2CO3 | AgI | Li2CO3 |
| 溶度积(K甲 ) | 2×10-10 | 1×10-11 | 8.5×10-17 | 8.64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0~t1min内CH3OH的平均生成速率为$\frac{{n}_{1}}{{t}_{1}}$1mol•L-1•min-1 | |
| D. | A点的反应体系温度从300℃升高到500℃,达到平衡时,$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com