
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
【答案】 Ar  Na HClO4 NaOH Al(OH) 3 H2O H2S
Na HClO4 NaOH Al(OH) 3 H2O H2S ![]() 离子键 离子 略
离子键 离子 略 ![]() 共价键(或极性共价键) 共价 略
共价键(或极性共价键) 共价 略
【解析】根据元素在周期表中的相对位置可知①~⑧种元素分别是C、N、O、Na、Al、S、Cl、Ar。则
(1)在这些元素中,化学性质最不活泼的是稀有气体Ar,这种元素的原子结构示意图为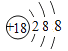 。(2)同周期自左向右原子半径逐渐减小,则④与⑤两种元素相比较,原子半径较大的是Na;同周期自左向右非金属性逐渐增强,最高价含氧酸的酸性逐渐增强,则在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是HClO4。在金属元素氧化物所对应的水化物中,碱性最强的化合物是NaOH,具有两性的化合物是Al(OH) 3。(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则③与⑥元素的氢化物的稳定性:H2O>H2S。(4)元素④和元素⑦形成化合物是含有离子键的离子化合物氯化钠,电子式为
。(2)同周期自左向右原子半径逐渐减小,则④与⑤两种元素相比较,原子半径较大的是Na;同周期自左向右非金属性逐渐增强,最高价含氧酸的酸性逐渐增强,则在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是HClO4。在金属元素氧化物所对应的水化物中,碱性最强的化合物是NaOH,具有两性的化合物是Al(OH) 3。(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则③与⑥元素的氢化物的稳定性:H2O>H2S。(4)元素④和元素⑦形成化合物是含有离子键的离子化合物氯化钠,电子式为![]() 。表示该化合物的形成过程为
。表示该化合物的形成过程为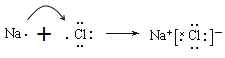 。(5)⑦的氢化物氯化氢是含有共价键的共价化合物,电子式为
。(5)⑦的氢化物氯化氢是含有共价键的共价化合物,电子式为![]() ,表示该化合物的形成过程为
,表示该化合物的形成过程为![]() 。
。


科目:高中化学 来源: 题型:
【题目】欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物。某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水。
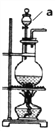
(1)红热的炭与浓硫酸发生反应的实验装置如图,仪器a的名称为________,在使用前需要检漏,检漏的方法是_________。
(2)能证明红热的炭与浓硫酸反应产物中有CO2的实验现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
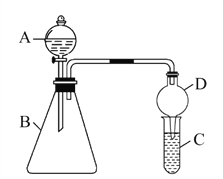
利用如图装置验证同主族元素非金属性的变化规律。
(1)干燥管D的作用为____。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象即可证明,写出C中反应的离子方程式_______________。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液____的现象,即可证明。但有同学认为该实验存在不足,请简要说明___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中相邻元素之间原子序数的关系正确的是( )
A.相邻主族的元素的原子序数之差一定都是1
B.主族中相邻元素的原子序数之差只有1、11、25
C.相邻周期元素的原子序数之差一定都是8
D.相邻周期元素的原子序数之差可能有2、8、18、32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等质量的锌片和铜片用导线相连并插入500 mL CuSO4溶液中构成如图所示的装置。

(1)该装置为________装置,该装置中发生反应的离子方程式为______________,铜片周围溶液会出现________的现象。
(2)若锌2 min后的质量减少1.3 g,则导线中流过的电子为________mol。
(3)若将该装置的电解质溶液换为FeCl3溶液,其正极反应为____________________。
Ⅱ.向2 L的密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g) pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2 min时,A的物质的量减少了
v(A);反应至2 min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() a mol·L-1,同时有a mol D生成。
a mol·L-1,同时有a mol D生成。
(1)0~2 min内,v(A)=________。
(2)该化学方程式中,y=________。
(3)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较,反应速率_______(填“增大”、“减小”或“不变”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=13的溶液中,能大量共存的离子组是:
A. Na+、NH4+、Clˉ、SO42ˉ B. K+、Na+、AlO2ˉ、Clˉ
C. Mg2+、K+、NO3ˉ、Clˉ D. K+、Na+、Al3+、SO42ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2![]() LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A. 放电时镍被还原 B. 放电时负极LaNi5H+OH——e—=LaNi5+H2O
C. 充电时OH—向阴极移动 D. 充电时每消耗lmol Ni(OH)2转移lmol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com