
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
分析 A.Na2O2能与CO2、H2O反应,均生成氧气;
B.光导纤维主要成分是二氧化硅;
C.胶体遇电解质溶液发生聚沉;
D.明矾净水是利用铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质作用.
解答 解:A.Na2O2能与CO2、H2O反应,均生成氧气,所以能够做供氧剂,故A正确;
B.光导纤维主要成分是二氧化硅,不是硅,故B错误;
C.黄河中的泥沙和豆浆都是胶体,胶体遇电解质溶液发生聚沉,故C正确;
D.明矾净水是利用铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质作用,所以明矾可用作净水剂,故D正确;
故选:B.
点评 本题考查了物质的性质和用途,熟悉过氧化钠、胶体、明矾、二氧化硅的性质是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 浓氨水和浓HNO3 | B. | 浓氨水和浓盐酸 | C. | 浓氨水和浓H2SO4 | D. | 浓氨水和浓H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与过量稀硫酸反应:OH-+Ba2++SO42-+H+=BaSO4↓+H2O | |
| B. | 碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
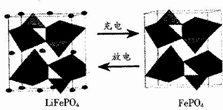 LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )| A. | 放电时该电极为负极 | |
| B. | 充电是Li+向阳极移动 | |
| C. | 充电时该电极发生氧化反应,反应式为LiFePO4-e-=FePO4+Li+ | |
| D. | 该电池可以用磷酸溶液作电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.57 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.61 | 1.8 | 2.1 | 2.5 | 3.0 |
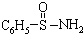 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
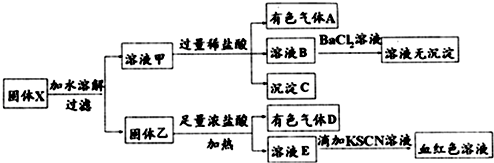
| A. | 溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2、K2CO3 | |
| B. | 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3 | |
| C. | 气体A和气体D一定均为纯净物 | |
| D. | 原混合物中一定含有MnO2、Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com