
制备(NH4)2FE(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:FE2+、H+、NH4+、Cl–、SO42–
B.加入少量NaClO溶液:NH4+、FE2+、H+、SO42–、ClO–
C.加入过量NaCl O和NaOH的混合溶液:Na+、SO42–、Cl–、ClO–、OH–
O和NaOH的混合溶液:Na+、SO42–、Cl–、ClO–、OH–
D.加入过量NaOH溶液:Na+、FE2+、NH4+、SO42–、OH–
科目:高中化学 来源:2016-2017学年四川省高二10月月考化学卷(解析版) 题型:选择题
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=30 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:填空题
I.某温度下,Kw = 10-12。
(1)若保持温度不变,向少量水中加入_________g的NaOH固体,并加水至1 L,才能使溶液中水电离产生的H+、OH-的浓度乘积即:c(H+)·c(OH-) = 10-22
(2)若保持温度不变,某溶液中c(H+)为1×10-7 mol/L,则该溶液显________性(选填“酸”、“碱”或“中”)。
II.(3)实验室中常用NaOH进行洗气和提纯,当600 mL 1 mol/L NaOH溶液吸收标准状况下8.96 L CO2气体时所得溶液中各离子浓度由大到小的顺序是 。
(4)已知常温下Kw[Fe(OH)3] = 4.0×10-38,在FeCl3溶液中加入NaHCO3溶液,发生反应的离子方程式为_____________。若所得悬浊液的pH调整为4,则溶液中Fe3+的浓度为__________mol/L。
(5)试利用平衡移动原理解释下列事实:FeS不溶于水,但能溶于稀盐酸中_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:选择题
含有一个双键的烯烃和H2加成后的产物结构如图,则该烯烃中碳碳双键位置异构的种数有( )
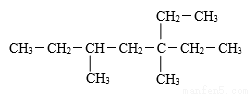
A.8 种 B.7种 C.6种 D.5种
查看答案和解析>>
科目:高中化学 来源:2017届湖北省襄阳市四校高三上学期期中化学试卷(解析版) 题型:推断题
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: 。
(2)B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则该方程式为 。已知煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,请写出其反应的化学方程式: 。
(3)E能使湿润的红色石蕊试纸变蓝,工业上常用E为原料制取硝酸,写出E催化氧化的化学方程式 ; E和氯气接触会产生白烟,该反应的化学方程式为 。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省襄阳市四校高三上学期期中化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变为无色。下列分析正确的是( )
A.通入SO2后溶液逐渐变成无色,体现了SO2的氧化性
B.滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物
D.上述实验条件下,物质的还原性:Cu+>I->SO2
查看答案和解析>>
科目:高中化学 来源:2017届湖北省襄阳市四校高三上学期期中化学试卷(解析版) 题型:选择题
化学 与生活密切
与生活密切 相关。下列有关说法不正确的是( )
相关。下列有关说法不正确的是( )
A.燃料的脱硫脱氮、NO的催化转 化都是减少酸雨产生的措施
化都是减少酸雨产生的措施
B.利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性
C.BaSO4难溶于水和强酸,在医学上常用作钡餐
D.食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上学期调研一化学试卷(解析版) 题型:实验题
锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为___________________;
(2) GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式_______________。
(3)下列有关镓和镓的化合物的说法正确的是____________
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
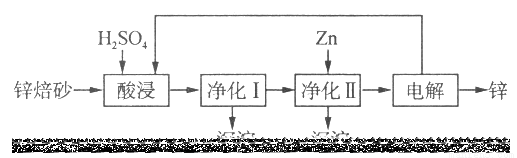
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为____ _。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是________________________。
(6)净化II中加入Zn的目的是_______________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3]=8.0×10-38;lg5=0.7
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三11月模拟化学卷(解析版) 题型:实验题
乙酸正丁酯是无色透明有愉快果香气味的液体,可由乙酸和正丁醇制备。反应的化学方程式如下: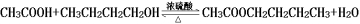
发生的副反应如下:
有关化合物的物理性质见下表:
化合物 | 密度(g·cm-3) | 水溶性 | 沸点(℃) |
冰乙酸 | 1.05 | 易溶 | 118.1 |
正丁醇 | 0.80 | 微溶 | 117.2 |
正丁醚 | 0.77 | 不溶 | 142.0 |
乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
已知:乙酸正丁酯、正丁醇和水组成三元共沸物恒沸点为90.7℃。
合成:
方案甲:采用装置甲(分水器预先加入水,使水面略低于分水器的支管口),在干燥的50mL圆底烧瓶 中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀。按下图安装好带分水器的回流反应装置,通
中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸和2g沸石,摇匀。按下图安装好带分水器的回流反应装置,通 冷却水,圆底烧瓶在电热套上加热煮沸。在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中)。反应基本完成后,停止加热。
冷却水,圆底烧瓶在电热套上加热煮沸。在反应过程中,通过分水器下部的旋塞分出生成的水(注意保持分水器中水层液面仍保持原来高度,使油层尽量回到圆底烧瓶中)。反应基本完成后,停止加热。
方案乙:采用装置乙,加料方式与方案甲相同。加热回流,反应60min后停止加热。
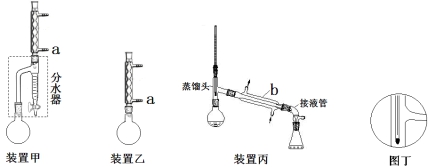
提纯:甲乙两方案均采用蒸馏方法。操作如下:

请回答:
(1)a处水流方向是 (填“进水”或“出水”),仪器b的名称 。
(2)合成步骤中,方案甲监控酯化反应已基本完成的标志是 。
(3)提纯过程中,步骤②是为了除去有机层中残留的酸,检验有机层已呈中性的操作是 ;步骤③的目的是 。
(4)下列有关洗涤过程中分液漏斗的使用正确的是 。
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.洗涤时振摇放气操作应如图所示
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
D.洗涤完成后,先放出下层液体,然后继续从下口放出有机层置于干燥的锥形瓶中
(5)按装置丙蒸馏,最后圆底烧瓶中残留的液体主要是 ;若按图丁放置温度计,则收集到的产品馏分中还含有 。
(6)实验结果表明方案甲的产率较高,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com