
| A. | 先加Cl2,再加Br2 | B. | 先加Cl2,再加HBr | C. | 先加HCl,再加HBr | D. | 先加HCl,再加Br2 |
分析 用2-丁炔为原料制取CH3CHBrCBrClCH3,即在碳碳三键两端的碳原子上分别加上1molHCl和1molBr2,据此分析.
解答 解:用2-丁炔为原料制取CH3CHBrCBrClCH3,即在碳碳三键两端的碳原子上分别加上1molHCl和1molBr2.
可以让2-丁炔先和HCl加成,得CH3CH=CClCH3,然后CH3CH=CClCH3再和Br2加成即得CH3CHBrCBrClCH3;
或者先让2-丁炔先和Br2加成,可得CH3CBr=CBrCH3,然后CH3CBr=CBrCH3再和HCl加成即可得CH3CHBrCBrClCH3,故选D.
点评 本题以有机合成为载体,考查炔烃的性质,难度不大,注意基础知识的掌握,注意根据分子组成分析.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取25.20gNaOH | |
| B. | 将称好的NaOH固体放入容量瓶中加入少量水溶解 | |
| C. | 未冷却就将烧杯中的NaOH溶液注入容量瓶中会导致溶液浓度偏高 | |
| D. | 定容时,液面超过了容量瓶刻度线,用胶头滴管吸出刻度线以上的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都增大 | B. | 正反应速率减小,逆反应速率增大 | ||
| C. | 平衡向逆反应方向移动 | D. | 混合气体中SO2的体积百分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
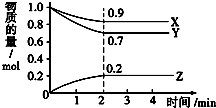 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 任何物质的摩尔质量就等于它的相对分子质量或相对原子质量 | |
| C. | 物质的量实质上是物质的质量 | |
| D. | 1mol H2SO4中含有2mol H、1mol S和4mol O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 温度越高,KW越大 | |
| B. | 温度越低,KW越大 | |
| C. | 随着温度的升高,KW可能增大也可能减小 | |
| D. | 随着温度的升高,KW肯定增大,H+和OH-浓度同时升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com