
【题目】当光束通过下列分散系时,能形成一条光亮的通路的是( )
A.食盐水B.酒精C.泥浆D. Fe(OH)3胶体
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1 , 他因此获得了1918年诺贝尔化学奖. 在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的转化率比是 .
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,
密度 . (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40s内用N2O4表示的平均反应速率为molL﹣1s﹣1 .
(2)计算在80℃时该反应的平衡常数K= .
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填字母).
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
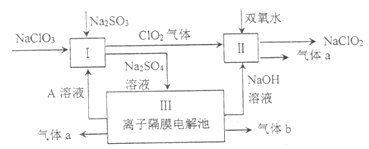
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
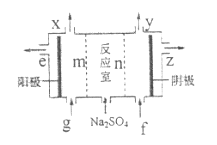
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室模拟用软锰矿(主要成分![]() ,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
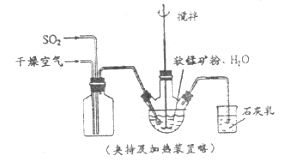
①缓慢向烧瓶中(见上图)通入过量混合气进行“浸锰”操作,主要反应原理为: ![]()
![]() (铁浸出后,过量的
(铁浸出后,过量的![]() 会将
会将![]() 还原为
还原为![]() )
)
②向“浸锰”结束后的烧瓶中加入一定量纯![]() 粉末。
粉末。
③再用![]() 溶液调节pH为3.5左右,过滤。
溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5-7.2,加入![]() ,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
(1)“浸锰”反应中往往有副产物![]() 的生成,温度对“浸锰”反应的影响如下图,为减少
的生成,温度对“浸锰”反应的影响如下图,为减少![]() 的生成,“浸锰”的适宜温度是___________。
的生成,“浸锰”的适宜温度是___________。
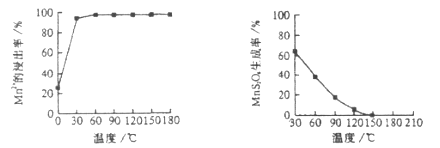
图1 温度对锰浸出率的影响 图2 浸锰温度与![]() 生成率的关系
生成率的关系
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯![]() 粉末的主要作用是_________,相应反应的离子方程式为_______。
粉末的主要作用是_________,相应反应的离子方程式为_______。
表1:生成相应氢氧化物的pH
物质 |
|
|
|
|
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有![]() ,可添加过量的难溶电解质MnS除去
,可添加过量的难溶电解质MnS除去![]() ,经过滤,得到纯净的
,经过滤,得到纯净的![]() 。用平衡移动原理解释加入MnS的作用__________。
。用平衡移动原理解释加入MnS的作用__________。
(4)④中加入![]() 后发生反应的离子方程式是__________。
后发生反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:

下列说法正确的是( )
A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
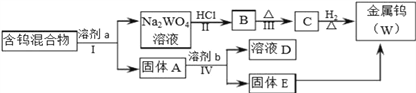
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________。
(2)WO3既属于金属氧化物,也属于__________(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________,固体E中含有的物质是_______________,D中的溶质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,E,F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( ) 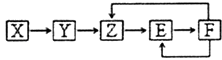
A.X可能是一种氢化物
B.X生成Z一定是化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com