
| A£® | ŗ¬ŃõĖįµÄĖįŠŌ”¢Ēā»ÆĪļµÄ·Šµć£ŗW£¾Z | |
| B£® | Ō×Ó°ė¾¶£ŗX£¾Y£¾W | |
| C£® | XµÄĒā»ÆĪļ”¢X2WČÜÓŚĖ®ŗóĖłµĆČÜŅŗ¶¼³Ź¼īŠŌ | |
| D£® | ZµÄ×īøß¼ŪŃõ»ÆĪļ³£ÓĆ×÷¹āµ¼ĻĖĪ¬ |
·ÖĪö X”¢Y”¢Z”¢WŹĒ“¦ÓŚĻąĮŚ¶ĢÖÜĘŚµÄ²»Ķ¬Ö÷×åŌŖĖŲ£®XµÄµ„ÖŹ³£ĪĀĻĀÄÜÓėĖ®¾ēĮŅ·“Ó¦£¬XĪŖNa£»ŗŚ»šŅ©ÓÉľĢæ·Ū£ØC£©”¢Įņ»Ē£ØS£©ŗĶĻõŹÆ£ØKNO3£©°“Ņ»¶Ø±ČĄżÅäÖʶų³ÉµÄ£¬WµÄµ„ÖŹŹĒŗŚ»šŅ©µÄÖ÷ŅŖ³É·ÖÖ®Ņ»£¬ĖüµÄŅ»ÖÖŃõ»ÆĪļÓŠ¶¾£¬Ņ×ČÜÓŚĖ®£¬ŌņWĪŖS£»ZµÄŌ×Ó°ė¾¶Š”ÓŚW£¬ZĪŖµŚ¶žÖÜĘŚŌŖĖŲ£¬ZµÄ×īĶā²ćµē×ÓŹżŹĒY×īĶā²ćµē×ÓŹżµÄ2±¶£¬ÉčYµÄ×īĶā²ćµē×ÓŹżĪŖn£¬ZµÄ×īĶā²ćµē×ÓŹżĪŖ2n£¬ĖÄÖÖŌŖĖŲµÄ×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ13£¬Ōņn+2n+1+6=13£¬½āµĆn=2£¬æÉÖŖZĪŖC£¬YĪŖMg»ņBe£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗÓÉÉĻŹö·ÖĪöæÉÖŖ£¬XĪŖNa£¬YĪŖMg»ņBe£¬ZĪŖC£¬WĪŖS£¬
A£®·Ē½šŹōŠŌW£¾Z£¬Ōņ×īøß¼Ūŗ¬ŃõĖįµÄĖįŠŌ£ŗW£¾Z£¬CµÄĒā»ÆĪļ³£ĪĀĻĀæÉÄÜĪŖĘųĢ¬”¢¹ĢĢ¬µČ£¬ČōĪŖ¹ĢĢ¬Ź±Ēā»ÆĪļµÄ·ŠµćZ£¾W£¬¹ŹA“ķĪó£»
B£®Ķ¬ÖÜĘŚ“Ó×óĻņÓŅŌ×Ó°ė¾¶¼õŠ”£¬µē×Ó²ćŌ½¶ąŌ×Ó°ė¾¶Ō½“ó£¬YĪŖMgŹ±Ō×Ó°ė¾¶£ŗX£¾Y£¾W£¬YĪŖBeŹ±Ō×Ó°ė¾¶£ŗX£¾W£¾Y£¬¹ŹB“ķĪó£»
C£®NaHÓėĖ®·“Ӧɜ³ÉNaOH£¬Na2SĖ®½āĻŌ¼īŠŌ£¬ŌņXµÄĒā»ÆĪļ”¢X2WČÜÓŚĖ®ŗóĖłµĆČÜŅŗ¶¼³Ź¼īŠŌ£¬¹ŹCÕżČ·£»
D£®ZµÄ×īøß¼ŪŃõ»ÆĪļĪŖCO2£¬¶ųSiO2³£ÓĆ×÷¹āµ¼ĻĖĪ¬£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éŌ×Ó½į¹¹ÓėŌŖĖŲÖÜĘŚĀÉ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕŌŖĖŲ»ÆŗĻĪļÖŖŹ¶”¢×īĶā²ćµē×ÓŹżĄ“ĶʶĻŌŖĖŲĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāY²»Č·¶Ø¼°¹ęĀÉŠŌÖŖŹ¶µÄÓ¦ÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£®


 ĒįĖÉŹī¼Ł×Üø“Ļ°ĻµĮŠ“š°ø
ĒįĖÉŹī¼Ł×Üø“Ļ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 L 0.1mol/L NaHSO3ČÜŅŗÖŠŗ¬ÓŠHSO3-Ąė×ÓŹżĪŖ0.1NA | |
| B£® | 50 mL 18.4 mol•L-1ÅØĮņĖįÓė×ćĮæĶ·“Ó¦£¬Éś³ÉSO2·Ö×ÓŹżĪŖ0.46 NA | |
| C£® | 1 mol H2ŗĶ1 mol I2³ä·Ö·“Ó¦£¬æɵƵ½HI·Ö×ÓŹżĪŖ2NA | |
| D£® | 2.2 g CO2Óė×ćĮæĆ¾·Ū·“Ó¦£¬×ŖŅʵē×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
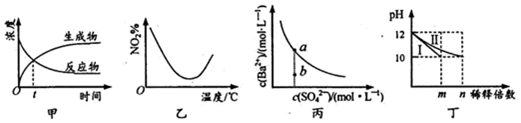
| A£® | Ķ¼¼×±ķŹ¾Ä³æÉÄę·“Ó¦ÖŠĪļÖŹÅضČĖꏱ¼äµÄ±ä»Æ£¬·“Ó¦ŌŚtŹ±æĢ“ļµ½Ę½ŗāדĢ¬ | |
| B£® | Ķ¼ŅŅ±ķŹ¾NO2ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ2NO2£Øg£©?N2O4£Øg£©£¬NO2Ģå»ż·ÖŹżÓėĪĀ¶ČµÄ±ä»ÆĒśĻߣ¬ŌņøĆ·“Ó¦µÄÕż·“Ó¦”÷H£¼O | |
| C£® | Ķ¼±ū±ķŹ¾Ä³ĪĀ¶ČŹ±£¬BaSO4ŌŚĖ®ÖŠµÄČܽāĘ½ŗāĒśĻߣ¬Õō·¢Ė®æÉŹ¹ČÜŅŗÓÉbµć±äµ½aµć | |
| D£® | Ķ¼¶”±ķŹ¾·Ö±šĻ”ŹĶl0mLpH¾łĪŖ12µÄNaOHŗĶNH3•H2OČÜŅŗŹ±pHµÄ±ä»Æ£¬ĒśĻßI±ķŹ¾NH3•H2OČÜŅŗ£¬n£¾100 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ėę×ÅŌ×ÓŠņŹżµÄŌö“ó£¬ŌŖĖŲµÄÖ÷ŅŖ»ÆŗĻ¼ŪÖš½„Ōö¼Ó | |
| B£® | Ėę×ÅĖę×ÅĻą¶ŌŌ×ÓÖŹĮæµÄŌö“ó£¬ŌŖĖŲµÄ»ÆѧŠŌÖŹ»į²»¶ĻÖŲø“ | |
| C£® | Óė¼ī½šŹōĻą±Č£¬ĘäĻąĮŚÖ÷×åµÄ£Ø¼īĶĮ£©½šŹō¾ßÓŠøüŠ”µÄĆܶČŗĶÓ²¶Č | |
| D£® | Ā±ĖŲĒā»ÆĪļµÄĪČ¶ØŠŌĖę×ÅŗĖµēŗÉŹżµÄŌö¼Ó¶ų¼õČõ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
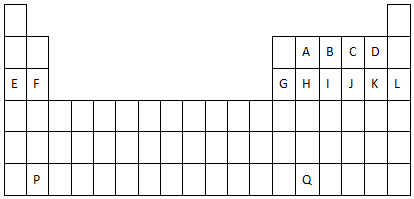
 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
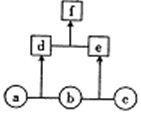 ČēĶ¼ĖłŹ¾£¬a”¢b”¢c¾łĪŖ·Ē½šŹōµ„ÖŹ£»d”¢e¾łĪŖ10µē×Ó¹²¼Ū»ÆŗĻĪļ£¬ĒŅ·Ö×ÓÖŠĖłŗ¬Ō×ÓŹż£ŗd£¾e£»fĪŖĄė×Ó»ÆŗĻĪļ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾£¬a”¢b”¢c¾łĪŖ·Ē½šŹōµ„ÖŹ£»d”¢e¾łĪŖ10µē×Ó¹²¼Ū»ÆŗĻĪļ£¬ĒŅ·Ö×ÓÖŠĖłŗ¬Ō×ÓŹż£ŗd£¾e£»fĪŖĄė×Ó»ÆŗĻĪļ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | fŹÜČČŅ×·Ö½āĪŖdŗĶe | |
| B£® | µ„ÖŹc¾ßÓŠĒ滹ŌŠŌ | |
| C£® | ĪČ¶ØŠŌ£ŗd£¾e | |
| D£® | µ„ÖŹaÖŠµÄŌŖĖŲŌŚÖÜĘŚ±ķÖŠĪ»ÓŚµŚ¶žÖÜĘŚµŚ¢öA×å |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČÜŅŗÖŠ$\frac{c£Ø{H}^{+}£©}{c£ØC{H}_{3}COOH£©}$µÄÖµŌö“ó | B£® | pHŌö“ó2øöµ„Ī» | ||
| C£® | ČÜŅŗÖŠc£ØOH-£©¼õŠ” | D£® | Kw¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
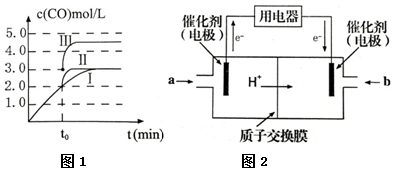
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cl2ĶØČėĖ®ÖŠ£ŗCl2+H2O?2H++Cl-+ClO- | |
| B£® | ÓĆĻ”ĻõĖįĻ“µÓŹŌ¹ÜÄŚ±ŚµÄŅų¾µ£ŗAg+2H++NO3-ØTAg++NO”ü+H2O | |
| C£® | ÓĆKIO3Ńõ»ÆĖįŠŌČÜŅŗÖŠµÄKI£ŗ5I-+IO3-+3H2OØT3I2+6OH- | |
| D£® | ĻņĆ÷·ÆČÜŅŗÖŠÖšµĪ¼ÓČėBa£ØOH£©2ČÜŅŗÖĮSO42-Ē”ŗĆ³ĮµķĶźČ«£ŗAl3++2SO42-+2Ba2++4OH-ØT2BaSO4”ż+AlO2-+2H2O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com