
A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。
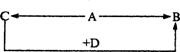 (1)A的电子式是 。
(1)A的电子式是 。
(2)把1 molCO2通入含2 molC的溶液后,溶液中各离子浓度由大到小的顺序是 。
(3)1 molA与2 molD固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体是 (用化学式表示)。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com