
(原创) 下列化学用语使用正确的是
A.N2的结构式:N = N
B.H2O的比例模型:
C.HClO的电子式: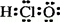
D.MgBr2的形成过程用电子式表示为: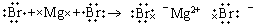
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:实验题
(15分)某实验小组用下图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
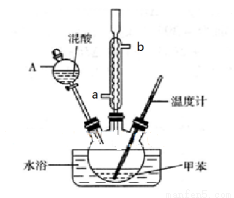
反应原理:
实验中可能用到的数据:
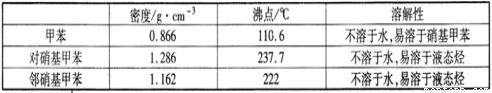
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许________,目的是____________________。
(2)冷凝管的作用是_________;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和________________、_________________。
(5)本实验中一硝基甲苯的产率为________(结果保留小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)科学家发现海洋是一个名副其实的“聚宝盆”,一些国家觊觎我国南海海域的丰富资源,导致近年来南海争端不断。下列对海洋资源开发利用的说法不正确的是
A.海底如“土豆”般的金属结核矿含有铁、锰、钴等多种元素,可用铝热法冶炼并分离得到各种金属单质
B.海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁、钠等
C.海水中的金、铀等元素储量高、浓度低,提炼时,须先富集
D.海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就地取材、降低成本的生产理念
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34g/mol,Y的最低价氢化物为非电解质。则下列说法中正确的是
| X | Y |
|
Z |
| W | Q |
A.阴离子还原性:W > Q
B.X的最低价氢化物能形成分子间氢键
C.Q单质能溶于水,且水溶液须用棕色细口瓶盛装
D.Na与Y能形成化合物Na2Y2,且与水反应后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:实验题
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B. 0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若 LpH=11的NaOH溶液与
LpH=11的NaOH溶液与 LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则 ≤
≤
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
对某芳香烃A分析结果如下:质谱图显示其最大质荷比为120,红外光谱显示其有两个甲基,核磁共振氢谱显示有五种峰且其面积比为1:2:2:1:6,A在有机合成中能发生如下转化:
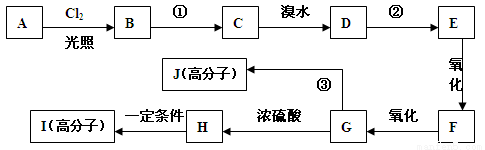
(已知:烃基发生取代反应的活性次序为 CH > CH2 > CH3 即叔氢>仲氢>伯氢)
回答以下问题:
(1)写出A的结构简式 ;
(2) 反应①和②相同的反应试剂和条件为 ;
(3)F分子中的含氧官能团名称是 ;
(4)反应③的化学方程式为: ;
(5)写出满足下列条件的H分子的所有同分异构体的结构简式:
①含有苯环 ②1 mol有机物发生银镜反应生成4 mol Ag ③苯环上的一溴代物有两种
;
(6)与H具有相同官能团的H的同分异构体有四种,其中一种分子K还存在顺反异构
体,试写出K的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:填空题
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:

①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com