
分析 (1)根据药品说明书可以知道主要成分,碘单质是紫黑色的固体;
(2)单质碘在水中的溶解度不大,可以用萃取的方法检验碘单质的存在;
(3)碘单质的性质:受热易升华.
解答 解:(1)该药品说明书指出:主要成分是分子碘,碘单质是紫黑色的固体,不用糖衣就可以知道不是白色的,
故答案为:I2;不是;
(2)①碘单质的检验可以采用萃取法:向碘水中加入萃取剂四氯化碳来检验,
故答案为:四氯化碳;
②四氯化碳和水是互不相溶的,碘单质易溶于四氯化碳中,不易溶于水,混合后会出现明显的现象:碘单质易溶于四氯化碳中显示紫色,
故答案为:分层,下层液体是紫色的;碘单质易溶于四氯化碳中,不易溶于水,且四氯化碳和水的密度不一样,碘单质在四氯化碳中有特殊的颜色;
(3)由于碘单质受热易升华,通常将碘单质密闭保存在遮光、阴凉处,故答案为:受热易升华.
点评 本题涉及碘单质的性质、碘单质的检验方法:萃取法、加入淀粉溶液的方法,注意物质的性质以及方法的归纳是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
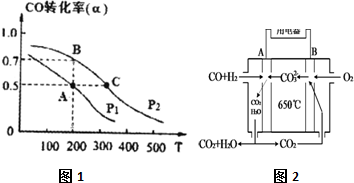
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
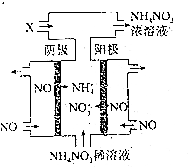
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ① | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com