
【题目】下列说法正确的是
A.氧化还原反应的本质是电子的转移
B.化合反应一定是氧化还原反应
C.物质中某元素的原子得到电子,则此物质是还原剂
D.酸、碱、盐之间的反应一定是复分解反应
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组用下图装置探究条件对Na2S2O3溶液与稀H2SO4反应速率的影响。请回答有关问题。
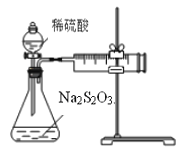
(1)写出该反应的离子方程式_______________________________________________________。
(2)连接好仪器后,开始实验前还需进行的操作是_____________________________________。
(3)现探究浓度对该反应速率(单位mL/min)的影响。
①应测定的实验数据为_____________。
②该实验实施过程中测定的气体体积比实际值偏小的一个重要原因是:____________________。
(4)若该小组同学设计了如下四组实验,
实验 | 反应温度 /℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | |||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 | |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 | |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 | |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 | |
① 实验数据体现了反应物__________(填化学式)的浓度及__________条件对反应速率的影响。
② 预测反应速率最快的一组实验序号为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜 - 锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是
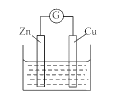
A. 锌电极上的反应为Zn- 2e-=Zn2+
B. 溶液中的SO42-向锌电极移动
C. 电子从锌电极经过硫酸铜溶液流向铜电极
D. 铜电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是___________(填字母);
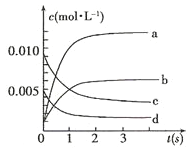
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
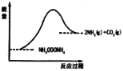
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于工业合成氨反应:N2+3H22NH3 , 下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100%
D.增大N2浓度可以增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关数据的比较,不正确的是( )
A. 元素的价电子数和所在族的族序数相等
B. NaOH晶体中的阳离子和阴离子数目相等
C. CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等
D. [Co(NH3)6]3+中的NH3分子数与配位键数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.
已知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJmol﹣1 . 请回答下列问题:
(1)图中A、C分别表示
(2)E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是
(3)图中△H=KJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com