


科目:高中化学 来源: 题型:
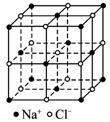
(1)已知阿伏加德罗常数的值(NA),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,则NaCl晶体的密度为_______________g·cm-3。
(2)某化学课外小组尝试在实验室中测定NaCl晶体的密度,其实验方案如下:先将固体NaCl研细,准确称量mgNaCl粉末并转移到容积为100 mL的定容仪器A中。然后,向A仪器中滴加苯,并不断振荡,至恰好达到刻度线时,测得加入苯的体积为V mL。
①定容仪器A最好选用______________________________ (填仪器名称)。
②能否用水代替苯_______________ (填“能”或“不能”);其理由是___________________。
③向仪器A中滴加苯时要不断振荡的目的是_______________________________________。
④使用该方法测得NaCl晶体的密度为_______________g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2011届河南省五市高中高三毕业班第二次联考(理综)化学部分 题型:单选题
已知阿伏加德罗常数的值为NA,下列说法正确的是
A.1mol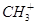 (甲基碳正离子)含有的电子数目为9NA (甲基碳正离子)含有的电子数目为9NA |
| B.标准状况下,2.24L甲苯含有的碳原子数目为0.7NA |
| C.6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA |
| D.1molHCl气体中的粒子数与0.5mol·L-1盐酸中溶质粒子数相等 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省五市高三毕业班第二次联考(理综)化学部分 题型:选择题
已知阿伏加德罗常数的值为NA,下列说法正确的是
A.1mol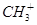 (甲基碳正离子)含有的电子数目为9NA
(甲基碳正离子)含有的电子数目为9NA
B.标准状况下,2.24L甲苯含有的碳原子数目为0.7NA
C.6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
D.1molHCl气体中的粒子数与0.5mol·L-1盐酸中溶质粒子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com