
分析 (1)基态Cr原子核外有24个电子,3d能级上有5个电子、4s能级上有1个电子,这六个电子都未成,Cr原子失去4s能级上1个电子、3d能级上2个电子生成Cr3+,该离子3d能级上电子为其价电子;
(2)原子轨道中电子处于半满、全满、全空时最稳定,原子越稳定,其第一电离能越大;
(3)在GaAs晶体中,距离每个Ga原子最近的As原子有4个,距离每个As原子最近的As原子个数=3×8÷2;
(4)与As同主族的短周期元素是N、P,所经AsH3的结构应与NH3相似,NH3分子之间有氢键,沸点较高;
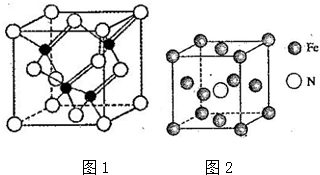
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为1×$\frac{1}{8}$+6×$\frac{1}{2}$=4,进而确定氮化铁的化学式,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)基态Cr原子核外有24个电子,3d能级上有5个电子、4s能级上有1个电子,这六个电子都未成,Cr原子失去4s能级上1个电子、3d能级上2个电子生成Cr3+,该离子3d能级上电子为其价电子,所以其价电子排布式为3d3,故答案为:6;3d3;
(2)原子轨道中电子处于半满、全满、全空时最稳定,原子越稳定,其第一电离能越大,Zn原子各个轨道上电子处于全满,Ga原子4p轨道上只有一个电子,所以第一电离能Zn>Ga,故答案为:Zn>Ga;
(3)在GaAs晶体中,距离每个Ga原子最近的As原子有4个,距离每个As原子最近的As原子个数=3×8÷2=12,
故答案为:4;12;
(4)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构应与NH3相似,AsH3中心原子杂化的类型为sp3,为三角锥形结构,NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3.PH3的混合气体降温是首先液化的是NH3,
故答案为:三角锥形;NH3;氨分子间存在氢键,分子间作用力更大,沸点更高,降温时先液化;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为1×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氮化铁的化学式为Fe4N,晶胞的体积为a3cm3,所以ρ=$\frac{m}{V}$=$\frac{\frac{56×4+14}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{238}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:Fe4N;$\frac{238}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、微粒空间构型判断、氢键等知识点,侧重考查学生知识综合应用、空间想象及计算能力,难点是晶胞计算,注意氢键只影响熔沸点而不影响氢化物稳定性.


科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
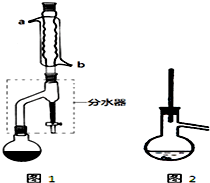 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
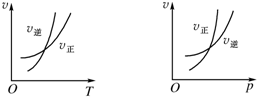 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )| A. | m<n+p,Q>0 | B. | m>n+p,Q>0 | C. | m<n+p,Q<0 | D. | m>n+p,Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{17}O$原子核内含有8个中子 | B. | ${\;}_{8}^{17}O$原子核内含有8个质子 | ||
| C. | ${\;}_{8}^{17}O$原子核外有17个电子 | D. | ${\;}_{8}^{17}O$原子核内含有17个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com