
¹żŃõ»ÆĒāĖ®ČÜŅŗĖ׳ĘĖ«ŃõĖ®£¬·Šµć±ČĖ®øߣ¬Óö¹ā”¢ČČ¼°ÖŲ½šŹō»ÆŗĻĪļµČ¾łÄÜŅżĘš·Ö½ā”£
£Ø1£©Ä³ŹŌ¼Į³§ĻČÖʵĆ7%~8%µÄĖ«ŃõĖ®£¬Óū½«ĘäÅØĖõ³É30%µÄČÜŅŗ£¬ŹŹŅĖ·½·ØŹĒ
£ØĢīŠ“±ąŗÅ£©”£
a£®³£Ń¹ÕōĮó ”” b£®¼õŃ¹ÕōĮó c£®¼ÓČėÉśŹÆ»Ņ³£Ń¹ÕōĮó ”””” d£®¼ÓŃ¹ÕōĮó
£Ø2£©Čē¹ūµĆµ½µÄĖ«ŃõĖ®ÖŠŃõŌŖĖŲµÄŗ¬ĮæĪŖ90%£¬Ōņ¹żŃõ»ÆĒāµÄ“æ¶ČĪŖ ”£ÖŚĖłÖÜÖŖ£¬ĒāĘųŌŚæÕĘųÖŠČ¼ÉÕÉś³ÉĖ®”£ÓŠČĖĢį³ö£¬ĒāĘųŌŚæÕĘųÖŠČ¼ÉÕŅ²æÉÄÜÉś³ÉH2O2£¬µ«ĖüŅņøßĪĀ¶ų·Ö½āĮĖ”£ĪŖĮĖŃéÖ¤ĒāĘųŌŚæÕĘųÖŠČ¼ÉյIJśĪļÖŠŹĒ·ńŗ¬ÓŠH2O2£¬Ä³æĪĶāŠ”×éĶ¬Ń§Éč¼ĘµÄŹµŃé×°ÖĆ¼ūĶ¼-1”£
£Ø3£©¼×Ķ¬Ń§Ļė“ÓĻĀĶ¼-2µÄ¢Ł£¢Ü֊єȔĢę“śĶ¼£1·½æņÖŠµÄ×°ÖĆ£¬æÉŠŠµÄŹĒ £ØĢīŠ“±ąŗÅ£©”£
£Ø4£©ČōŅŅĶ¬Ń§ÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗ¼ģ²āµ½ĮĖH2O2µÄ“ęŌŚ£¬Ķź³ÉøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ
”ś + ”” Mn2+ + H2O
±ūĶ¬Ń§¶ŌŅŅµÄ¼ģŃé·½°øĢį³öĮĖÖŹŅÉ£ŗČōŠæĮ£ÓėĻ”ĮņĖįµÄ·“Ó¦ÖŠ²śÉśĮĖÉŁĮæH2SµČ»¹ŌŠŌĘųĢ壬Ņ²»įŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«”£Ēė¶ŌŅŅĶ¬Ń§µÄŹµŃé·½°øĢį³öøĽų½ØŅé£ŗ ”£
£Ø5£©¹żĢ¼ĖįÄĘ£Ø2Na2CO3?3H2O2£©Ė×³Ę¹ĢĢåĖ«ŃõĖ®£¬¼«Ņ×·Ö½ā£¬Ęä·Ö½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗ2 (2Na2CO3?3H2O2) ”ś 4Na2CO3 + 6H2O + 3O2”ü
Č”Ņ»¶ØĮæµÄ¹żĢ¼ĖįÄĘŌŚĆܱÕČŻĘ÷ÖŠŹ¹ĖüĶźČ«·Ö½ā£¬²āµĆÉś³ÉŃõĘų12.0g”£ĄäČ“µ½ŹŅĪĀŗó£¬ĻņĖłµĆ²śĪļÖŠ¼ÓĖ®ÅäÖĘ³É10.6% µÄNa2CO3ČÜŅŗ£¬Šč¼ÓĖ® g”£
£Ø1£©b£Ø2·Ö£©
£Ø2£©21.25%””£Ø2·Ö£¬Š“0.2125øųČ«·Ö£©
£Ø3£©¢Ś£Ø2·Ö£©
£Ø4£©2MnO4-+5H2O2+6H+”ś2Mn2++5O2”ü+8H2O£Ø2·Ö£¬ĪļÖŹÕżČ·Š“Č«1·Ö£¬ÅäĘ½1·Ö£©£»
ĻČ½«ÖʵƵÄĒāĘųĶعż×°ÓŠ¼īŹÆ»ŅµÄøÉŌļ¹Ü£¬Č»ŗóµćČ¼”££ØŗĻĄķ£¬øų·Ö£©£Ø2·Ö£©
£Ø5£©433.5g£Ø2·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©Ė«ŃõĖ®ŹÜČČ»į·Ö½ā£¬Ö»ÓŠĶعż¼õŃ¹ÕōĮó½µµĶĪĀ¶ČŗóÕō³öŅŌ·ĄĘä·Ö½ā£»
£Ø2£©Ė«ŃõĖ®ÖŠŗ¬ŃõµÄĪļÖŹÓŠ£ŗH2O2ŗĶH2O£¬ÉčĪļÖŹµÄĮæ·Ö±šĪŖxŗĶy£¬ŌņÓÉĖ«ŃõĖ®ÖŠŃõŌŖĖŲµÄŗ¬ĮæĪŖ90%£¬Ōņ¹żŃõ»ÆĒāµÄ“æ¶ČĪŖ±ķŹ¾ĪŖ£ŗ16/90%="18y+34x" ,(2x+3y)*16/(34x+18y)=90%,»Æ¼ņµĆ£ŗ2x+y=1,µĆx=9-8/0.9”£ĒóµĆ34x/(34x+18y)=21.25%”£
£Ø3£©Ķ¼£1·½æņÖŠµÄ×°ÖĆŹĒĘōĘ×·¢ÉśĘ÷×°ÖĆ£¬Āś×ćĢõ¼žµÄŹĒ¢Ś£¬æÉŅŌĶعżŹ¹¹ĢŅŗ·ÖĄė“Ó¶ųŹ¹·“Ó¦Ķ£Ö¹·¢Éś”£
£Ø4£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦ŌĄķ£¬æÉŠ“³ö2MnO4-+5H2O2+6H+”ś2Mn2++5O2”ü+8H2O”£Ļąµ±ÓŚŃéÖ¤ĒāĘųÖŠŹĒ·ńŗ¬ÓŠH2SĘųĢ壬æÉŅŌ°Ń»ģŗĻĘųĢåĶØČėµ½ĮņĖįĶČÜŅŗÖŠČō²śÉśŗŚÉ«³Įµķ£¬¼“ÓŠH2SĘųĢ唣Ņ²æÉŅŌĻČ½«ÖʵƵÄĒāĘųĶعż×°ÓŠ¼īŹÆ»ŅµÄøÉŌļ¹Ü£¬Č»ŗóµćČ¼”£
£Ø5£©øł¾Ż·½³ĢŹ½2 (2Na2CO3?3H2O2) ”ś 4Na2CO3 + 6H2O + 3O2”ü£¬µ±Éś³ÉÉś³ÉŃõĘų12.0gŹ±£¬Éś³ÉĢ¼ĖįÄĘ12*4*106/(3*32)=53g£¬Éś³ÉĖ®µÄÖŹĮæĪŖ£ŗ(0.5*6/4)*18=13.5g”£ŅŖÅäÖĘ³É10.6% µÄNa2CO3ČÜŅŗ£¬Šč¼ÓĖ®(53/0.106 )-53-13.5=433.5g”£
æ¼µć£ŗ±¾Ģāæ¼²éĮĖŹµŃéŌĄķµÄ·ÖĪö£¬Ńõ»Æ»¹Ō·“Ó¦·½³ĢŹ½µÄÅäĘ½ŗĶČÜŅŗÖŹĮæ·ÖŹżµÄ¼ĘĖć”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ēā»ÆŃĒĶ(CuH)ŹĒŅ»ÖÖÄŃČÜĪļÖŹ,ÓĆCuSO4ČÜŅŗŗĶ”°ĮķŅ»ĪļÖŹ”±ŌŚ40”«50 ”ꏱ·“Ó¦æÉÉś³ÉĖü”£CuH²»ĪȶØ,Ņ×·Ö½ā;ŌŚĀČĘųÖŠÄÜČ¼ÉÕ;ÓėĻ”ŃĪĖį·“Ó¦ÄÜÉś³ÉĘųĢå;Cu+ŌŚĖįŠŌĢõ¼žĻĀ·¢ÉśµÄ·“Ó¦ŹĒ2Cu+ Cu2++Cu”£øł¾ŻŅŌÉĻŠÅĻ¢,½įŗĻ×Ō¼ŗĖłÕĘĪյĻÆѧÖŖŹ¶,»Ų“š:
Cu2++Cu”£øł¾ŻŅŌÉĻŠÅĻ¢,½įŗĻ×Ō¼ŗĖłÕĘĪյĻÆѧÖŖŹ¶,»Ų“š:
(1)ÓĆCuSO4ČÜŅŗŗĶ”°ĮķŅ»ĪļÖŹ”±ÖĘCuHµÄ·“Ó¦ÖŠ,ÓĆŃõ»Æ»¹Ō¹Ūµć·ÖĪö,Õā”°ĮķŅ»ĪļÖŹ”±ŌŚ·“Ó¦ÖŠĖłĘšµÄ×÷ÓĆŹĒ”””””””””””””””””””””””£
(2)Š“³öCuHŌŚĀČĘųÖŠČ¼ÉյĻÆѧ·“Ó¦·½³ĢŹ½
(3)CuHČܽāŌŚĻ”ŃĪĖįÖŠÉś³ÉµÄĘųĢåŹĒ””””””””,Čē¹ū·“Ó¦ÖŠÉś³ÉĮĖ±ź×¼×“æöĻĀ22.4 LµÄĘųĢå,±»»¹ŌµÄĄė×ӵƵē×ÓµÄĪļÖŹµÄĮæŹĒ”””””””””£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŠŪ»Ę£ØAs4S4£©ŗĶ“Ę»Ę£ØAs2S3£©ŹĒĢįČ”ÉéµÄÖ÷ŅŖæóĪļŌĮĻ£¬¶žÕßŌŚ×ŌČ»½ēÖŠ¹²Éś”£øł¾ŻĢāŅāĶź³ÉĻĀĮŠĢīæÕ£ŗ
£Ø1£©As2S3ŗĶSnCl2ŌŚŃĪĖįÖŠ·“Ó¦×Ŗ»ÆĪŖAs4S4ŗĶSnCl4²¢·Å³öH2SĘųĢ唣ČōAs2S3ŗĶSnCl2ÕżŗĆĶźČ«·“Ó¦£¬As2S3ŗĶSnCl2µÄĪļÖŹµÄĮæÖ®±ČĪŖ______”£
£Ø2£©ÉĻŹö·“Ó¦ÖŠµÄŃõ»Æ¼ĮŹĒ______£¬·“Ó¦²śÉśµÄĘųĢåæÉÓĆ______ĪüŹÕ”£
£Ø3£©As2S3ŗĶHNO3ÓŠČēĻĀ·“Ó¦£ŗ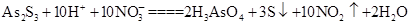 £¬ČōÉś³É2 mol H3AsO4£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ______”£Čō½«øĆ·“Ó¦Éč¼Ę³ÉŅ»Ōµē³Ų£¬ŌņNO2Ó¦øĆŌŚ______£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©ø½½üŅŻ³ö”£
£¬ČōÉś³É2 mol H3AsO4£¬Ōņ·“Ó¦ÖŠ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ______”£Čō½«øĆ·“Ó¦Éč¼Ę³ÉŅ»Ōµē³Ų£¬ŌņNO2Ó¦øĆŌŚ______£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©ø½½üŅŻ³ö”£
£Ø4£©Čō·“Ó¦²śĪļNO2Óė11.2 L O2£Ø±ź×¼×“æö£©»ģŗĻŗóÓĆĖ®ĪüŹÕČ«²æ×Ŗ»Æ³ÉÅØĻõĖį£¬Č»ŗóÓė¹żĮæµÄC·“Ó¦£¬Ėł²śÉśµÄCO2µÄĮæ______£ØŃ”Ģī±ąŗÅ£©”£
a£®Š”ÓŚ0.5 mol
b£®µČÓŚ0.5 mol
c£®“óÓŚ0.5 mol
d£®ĪŽ·ØČ·¶Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŹµŃéŹŅĄļ³£ÓĆÅØŃĪĖįÓė¶žŃõ»ÆĆĢ·“Ó¦Ą“ÖĘȔɣĮæµÄĀČĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
MnO2£«4HCl(ÅØ)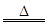 MnCl2£«Cl2”ü£«2H2O
MnCl2£«Cl2”ü£«2H2O
£Ø1£©·“Ó¦ĪļÖŠ£¬Ńõ»Æ¼ĮŹĒ________£»»ÆŗĻ¼ŪÉżøßµÄŌŖĖŲŹĒ________”£
£Ø2£©Č”Ņ»¶ØĢå»żµÄÅØŃĪĖįÓėMnO2·¢Éś·“Ó¦£¬²śÉśµÄĀČĘųŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ1.12 L(ŗöĀŌCl2µÄČܽā)”£Ōņ²Ī¼Ó·“Ó¦µÄHClµÄĪļÖŹµÄĮæŹĒ________£»·“Ó¦ÖŠ±»Ńõ»ÆµÄHClµÄÖŹĮæŹĒ________”£(Š“³ö¼ņŅŖ½āĢā¹ż³Ģ)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
µŖŌŖĖŲŹ®·ÖÖŲŅŖ£¬Ę䵄֏¼°Ęä»ÆŗĻĪļŌŚæĘŃŠ”¢Éś²śĮģÓņÓŠ×ÅŹ®·Ö¹ć·ŗµÄÓĆĶ¾”£
£Ø1£©µŖŌŖĖŲŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ£ŗ £¬Ō×ÓŗĖĶā¹²ÓŠ ÖÖ²»Ķ¬Äܼ¶µÄµē×Ó£¬µŖŌ×ÓŗĖĶāµē×ÓŌĘÓŠ ÖÖ²»Ķ¬µÄÉģÕ¹·½Ļņ£¬ÓŠ ÖÖ²»Ķ¬ŌĖ¶ÆדĢ¬µÄµē×Ó”£
£Ø2£©×īŠĀ”°ČĖ¹¤¹ĢµŖ”±µÄŃŠ¾æ±ØµĄ£ŗ³£ĪĀ³£Ń¹”¢¹āÕÕĢõ¼žĻĀ£¬N2ŌŚ“߻ƼĮ±ķĆęÓėĖ®·¢Éś·“Ó¦£ŗ
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q £¬Čē¹ū·“Ó¦µÄĘ½ŗā³£ŹżKÖµ±ä“ó£¬øĆ·“Ó¦ £ØŃ”Ģī±ąŗÅ£©”£
4NH3 (g)+3O2 (g) - Q £¬Čē¹ū·“Ó¦µÄĘ½ŗā³£ŹżKÖµ±ä“ó£¬øĆ·“Ó¦ £ØŃ”Ģī±ąŗÅ£©”£
A£®Ņ»¶ØĻņÕż·“Ó¦·½ĻņŅʶÆ
B£®ŌŚĘ½ŗāŅĘ¶ÆŹ±Õż·“Ó¦ĖŁĀŹĻČŌö“óŗó¼õŠ”
C£®Ņ»¶ØĻņÄę·“Ó¦·½ĻņŅʶÆ
D£®ŌŚĘ½ŗāŅĘ¶ÆŹ±Äę·“Ó¦ĖŁĀŹĻČ¼õŠ”ŗóŌö“ó
£Ø3£©Čē¹ūÉĻŹö·“Ó¦ŌŚĢå»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬µ±·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻĀĮŠÅŠ¶Ļ“ķĪóµÄŹĒ
A£®ČŻĘ÷ÖŠĘųĢåµÄĘ½¾ł·Ö×ÓĮæ²»Ėꏱ¼ä¶ų±ä»Æ B£®ĶØČė“óĮæĻ”ÓŠĘųĢåÄÜĢįøß·“Ó¦µÄĖŁĀŹ
C£®ČŻĘ÷ÖŠĘųĢåµÄĆÜ¶Č²»Ėꏱ¼ä¶ų±ä»Æ D£®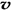 £ØN2£©/
£ØN2£©/ 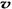 £ØO2£©=2:3
£ØO2£©=2:3
£Ø4£©øßĀČĖįļ§×÷ĪŖ»š¼żČ¼ĮĻµÄÖŲŅŖŃõŌŲĢ唣øßĀČĖįļ§ŌŚøßŃ¹”¢450”ęµÄĢõ¼žĻĀŃøĖŁ·Ö½ā£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½4NH4ClO4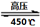 6H2O”ü+ 2N2”ü+ 4HCl”ü+ 5O2”ü£¬ĘäÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČŹĒ £¬Ćæ·Ö½ā1moløßĀČĖįļ§£¬×ŖŅʵĵē×ÓŹżÄæŹĒ ”£
6H2O”ü+ 2N2”ü+ 4HCl”ü+ 5O2”ü£¬ĘäÖŠŃõ»Æ²śĪļÓė»¹Ō²śĪļµÄĪļÖŹµÄĮæÖ®±ČŹĒ £¬Ćæ·Ö½ā1moløßĀČĖįļ§£¬×ŖŅʵĵē×ÓŹżÄæŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ĮņĖį¹¤³§µÄŃĢĘųÖŠŗ¬ÓŠSO2£¬ÓŠ¶ąÖÖ·½·ØæÉŹµĻÖŃĢĘųĶŃĮņ”£
£Ø1£©¹¤ŅµÖĘĮņĖįµÄ¹ż³ĢÖŠ£¬SO2±»ŃõĘųŃõ»ÆµÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø2£©”°ŹŖŹ½ĪüŹÕ·Ø”±ĄūÓĆĪüŹÕ¼ĮÓėSO2·¢Éś·“Ó¦“Ó¶ųĶŃĮņ”£
ŅŃÖŖ£ŗ25”ꏱ£¬H2SO3  HSO3 -+H+ K=1.5”Į10-2
HSO3 -+H+ K=1.5”Į10-2
H2CO3 HCO3 -+H+ K=4.4”Į10-7
HCO3 -+H+ K=4.4”Į10-7
ĻĀĮŠŹŌ¼ĮÖŠŹŹŗĻÓĆ×÷øĆ·ØĪüŹÕ¼ĮµÄŹĒ £ØĢī×ÖÄøŠņŗÅ£©”£
a.ŹÆ»ŅČé b. Na2SO3ČÜŅŗ c. Na2CO3ČÜŅŗ
¢Ś”°ÄĘ¼ī·Ø”±ÓĆNaOHČÜŅŗ×÷ĪüŹÕ¼Į£¬Ļņ100 mL 0.2 mol”¤L-1µÄNaOHČÜŅŗÖŠĶØČė±ź×¼×“æöĻĀ0.448 L SO2ĘųĢ壬·“Ó¦ŗó²āµĆČÜŅŗpH<7£¬ŌņČÜŅŗÖŠĻĀĮŠø÷Ąė×ÓÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ £ØĢī×ÖÄøŠņŗÅ£©”£
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
£Ø3£©Ä³ĮņĖį³§ÄāÓĆŃĢĘų“¦Ąķŗ¬Cr2O72-µÄĖįŠŌ·ĻĖ®£¬ŌŚĶŃĮņµÄĶ¬Ź±ÖʱøCr2O3²śĘ·”£¾ßĢåĮ÷³ĢČēĻĀ£ŗ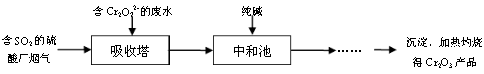
¢ŁĪüŹÕĖžÖŠ·“Ó¦ŗóµÄøõŌŖĖŲŅŌCr3+ŠĪŹ½“ęŌŚ£¬ŌņĘäÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
¢ŚÖŠŗĶ³ŲÖŠµÄ·“Ó¦³żÉś³ÉCr(OH)3³ĮµķĶā£¬»¹»į²śÉśÄ³ÖÖĘųĢ壬øĆĘųĢåµÄ»ÆѧŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ij»Æѧ·“Ó¦µÄ·“Ó¦ĪļŗĶ²śĪļČēĻĀ£ŗAl£«NaNO3£«H2O Al(OH)3£«N2£«NaAlO2
Al(OH)3£«N2£«NaAlO2
£Ø1£©øĆ·“Ó¦µÄŃõ»Æ¼ĮŹĒ______________”£
£Ø2£©øĆ·“Ó¦µÄŃõ»Æ²śĪļŹĒ_______________”£
£Ø3£©·“Ó¦¹ż³ĢÖŠ×ŖŅĘ5 mol e££¬Éś³É±ź×¼×“æöĻĀN2µÄĢå»ż________L”£
£Ø4£©ÅäĘ½øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
______Al£«_____NaNO3£«_____H2O==______Al(OH)3£«______N2£«______NaAlO2”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŅŃÖŖ·“Ó¦£ŗ3Cl2+8NH3==N2+6NH4Cl
£Ø1£©ČōÓŠ71gCl2²Ī¼Ó·“Ó¦£¬±»Ńõ»ÆµÄĪļÖŹŹĒ £»×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ mol”£
£Ø2£©·“Ó¦ŗó£¬Čō²śÉś14g N2£¬ŌņÓŠ g NH3±»Ńõ»Æ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ė®ŹĒČĖĄąÉś“ęŗĶ·¢Õ¹µÄ±¦¹ó׏Ō“£¬¶ųĖ®ÖŹµÄĪŪČ¾ĪŹĢāČ“Ō½Ą“Ō½ŃĻÖŲ”£ÄæĒ°£¬ŹĄ½ēø÷¹śŅŃø߶ČÖŲŹÓÕāøöĪŹĢā£¬²¢²ÉČ”»ż¼«“ėŹ©½ųŠŠÖĪĄķ”£
£Ø1£©¹¤Ņµ·ĻĖ®ÖŠ³£ŗ¬ÓŠ²»Ķ¬ĄąŠĶµÄĪŪČ¾Īļ£¬æɲÉÓĆ²»Ķ¬µÄ·½·Ø“¦Ąķ”£ŅŌĻĀ“¦Ąķ“ėŹ©ŗĶ·½·Ø¶¼ÕżČ·µÄŹĒ________£ØĢī×ÖÄø±ąŗÅ£¬æɶąŃ”£©”£
| Ń”Ļī | ĪŪČ¾Īļ | “¦Ąķ“ėŹ© | ·½·ØĄą±š |
| A | ·ĻĖį | ¼ÓÉśŹÆ»ŅÖŠŗĶ | ĪļĄķ·Ø |
| B | Cu2+µČÖŲ½šŹōĄė×Ó | ¼ÓĮņĖįŃĪ³Į½µ | »Æѧ·Ø |
| C | ŗ¬“æ¼īµÄ·ĻĖ® | ¼ÓŹÆ»ŅĖ®·“Ó¦ | »Æѧ·Ø |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com