
【题目】在0.1L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
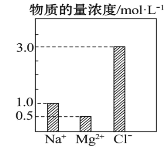
A.NaCl的物质的量为0.1mol
B.溶质MgCl2的质量为4.75g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1L,稀释后溶液中的Na+物质的量的浓度为0.1mol·L-1
【答案】C
【解析】
A、由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.1L×1.0mol/L=0.1mol,故A正确;
B、c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.1L×0.5mol/L×95g/mol=4.75g,故B正确;
C、根据电荷守恒可知,2c(Ba2+)+c(Na+)+2c(Mg2+)=c(Cl-),即2c(Ba2+)+1.0mol/L +2×0.5mol/L =3.0mol/L,解得:c(Ba2+)=0.5mol/L,BaCl2的物质的量为:0.5mol/L×0.1L=0.05mol,故C错误;
D、该混合液中,NaCl的物质的量为0.1mol,即钠离子的物质的量为0.1mol,将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量浓度为![]() =0.1mol/L,故D正确;
=0.1mol/L,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】石油是一种重要的能源,通过石油分馏可得到重油,以重油为原料,可合成X:CH3COOCH=CH2。其中A是最简单的烯烃,B能发生银镜反应,D的相对分子质量比A小2。请回答下列有关问题:
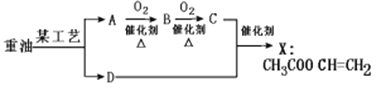
(1)A中的官能团名称是___________________
(2)B→C的化学方程式_____________________________
(3)已知C与D发生加成反应生成X,其化学方程式为________________________
(4)下列说法正确的是_____
A.此处的“某工艺”指的是分馏 B.B在一定条件下能与氢气发生加成反应
C.X不溶于水,能使酸性高锰酸钾溶液褪色 D.可用溴的四氯化碳溶液鉴别A和D
(5)F是X的同分异构体,1molF能与4molAg(NH3)2OH反应,写出F可能的结构简式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
D. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:生成1molNH3需要___(填“吸收”或“放出”)能量___kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,2.24LCO2中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含原子总数为NA
C.在室温和常压下,72g36Cl2中含有36Cl原子的数目为2NA
D.18g重水D2O中所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol HNO3见光分解,转移电子数4NA
B. 含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA
C. 100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D. 1 mol Na2O2晶体含有NA个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生 反应:CO(g)+2H2(g)=CH3OH(g),ΔH=a kJ/mol,如图。下列分析中正确的是

A.250°C时,010minH2 反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量______g;
(2)有以下仪器:①烧杯②药匙 ③250mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平⑦量筒.配制时,必须使用的玻璃仪器______(填序号),还缺少的仪器是______;
(3)使用容量瓶前必须进行的一步操作是______;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为______(填序号);
①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移
(5)配制过程中,下列操作会引起结果偏高的是______(填序号);
①未洗涤烧杯、玻璃棒;
②称量NaOH的时间太长;
③定容时俯视刻度;
④容量瓶不干燥,含有少量蒸馏水;
⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)某同学用浓硫酸配制的稀硫酸浓度偏低,则可能的原因是______(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因_____________________ (多选题)
A.定容时液面低于刻度线
B.未冷却到室温就定容
C.定容时液面高于刻度线
D.量取浓硫酸时俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com