
| 离子 | K+ | Na+ | NH4+ | SO42- | NO8- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都属于烃 |
| B、乙醇既能被氧化为乙醛也能被氧化为乙酸 |
| C、乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应 |
| D、淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、SO42-、Na+、SiO32- |
| B、Ag+、Fe3+、Cl-、SO42- |
| C、K+、SO42-、Mg2+、NO3- |
| D、H+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
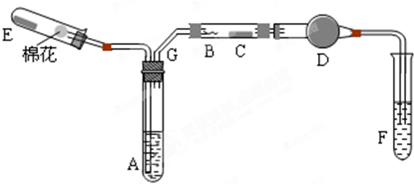
查看答案和解析>>
科目:高中化学 来源: 题型:
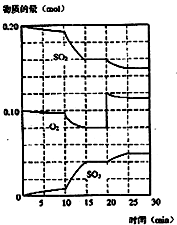 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 灼烧 |
| 浸泡 |
| 过滤 |
| 氧化 |
| 萃取分液 |
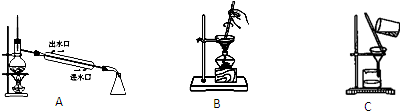
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
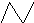 ,有机物A的键线式结构为
,有机物A的键线式结构为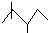 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A.则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com