
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O

科目:高中化学 来源:不详 题型:单选题
| A.NO+NO2+2NaOH==2NaNO3+H2O | B.NH3+HCl== NH4Cl |
| C.Br2+2KI==I2+2KBr | D.2H2O2==2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
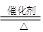 4NO + 6H2O ,其中作为还原剂的物质是 (填化学式);若反应中生成了0.2 mol NO,则转移 mol电子,
4NO + 6H2O ,其中作为还原剂的物质是 (填化学式);若反应中生成了0.2 mol NO,则转移 mol电子,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C12是氧化剂 | B.H2SO4是氧化产物 |
| C.反应中S元素的价态降低 | D.反应中H2O被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
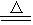 MnCl2+Cl2↑ + 2H2O,
MnCl2+Cl2↑ + 2H2O,查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 选用试剂 | 实验现象 |
| 方案1 | | |
| 方案2 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
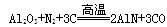 ,下列叙述正确的是 ( )
,下列叙述正确的是 ( )| A.AlN中氮的化合价为+3 |
| B.AlN的摩尔质量为41 g |
| C.上述反应中,N2是氧化剂,Al2O3 既不是氧化剂也不是还原剂。 |
| D.上述反应中,每生成1 mol AlN需转移6 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com