
| A. | 100g质量分数为46%的乙醇水溶液中氧原子数为4NA | |
| B. | 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2 NA | |
| C. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| D. | 25℃时,KSP(BaSO4)=l×10-10,则BaSO4饱和溶液中Ba2+数目为l×10-5NA |
分析 A.乙醇溶液中除了乙醇外,水也含氧原子;
B.氯气和水反应生成盐酸和次氯酸,为化学平衡;
C.求出氢气的物质的量,然后根据重氢中含2个中子来分析;
D.饱和溶液体积不知不能计算微粒数.
解答 解:A.乙醇溶液中除了乙醇外,水也含氧原子,100g46%的乙醇溶液中,乙醇的质量为46g,物质的量为1mol,故含1mol氧原子;水的质量为100g-46g=54g,物质的量为3mol,故含3mol氧原子,故此溶液中含有的氧原子的物质的量共为4mol,个数为4NA个,故A正确;
B.1molCl2通入水中反应生成盐酸和次氯酸,盐酸守恒可知,2Cl2+HClO+Cl-+ClO-粒子数之和等于2 NA ,HClO、Cl-、ClO-粒子数之和小于2 NA,故B正确;
C.标况下2.24L重氢的物质的量为0.1mol,而重氢中含2个中子,故0.1mol重氢中含0.2NA个电子,故C正确;
D.25℃时,KSP(BaSO4)=l×10-10,则BaSO4饱和溶液中Ba2+浓度为l×10-5NA,溶液体积不知不能计算微粒数,故D错误;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,题目难度中等,应注意掌握公式的运用和物质的结构、气体摩尔体积概念计算、可逆反应的存在等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为10 的氧原子:10O | |
| B. | 过氧化氢的电子式:H-O-O-H | |
| C. | CS2中各原子最外层都满足8 电子结构 | |
| D. | CH2Cl2是四面体构型的含非极性健的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF比H2O稳定性更强,是由于HF分子间作用力较大 | |
| B. | CC14、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构 | |
| C. | Na投入到水中,有共价键的断裂与形成 | |
| D. | 离子化合物中一定含有离子键,可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 有机物 | 水杨酸 | 冬青油 | 阿司匹林 |
结构简式 |  |  | 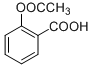 |
| A. | 可以用FeCl3溶液鉴别冬青油和阿司匹林 | |
| B. | 由水杨酸制冬青油的反应是取代反应 | |
| C. | 1mol阿司匹林最多能与3 mol NaOH反应 | |
| D. | 可以用碳酸钠溶液除去冬青油中少量的水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸清洗锅炉中的水垢 | |
| B. | Na2O2 用作呼吸面具的供氧剂 | |
| C. | 氯水中通入SO2 后溶液的酸性减弱 | |
| D. | N2 与O2 在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | lmol N2、3molH2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | C甲 | C乙 | C丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | V乙 | V丙 |
| A. | V甲>V丙 | B. | C乙>C甲 | C. | K乙>K丙 | D. | V甲=V丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | S2-的结构示意图: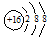 | ||
| C. | CaO2的电子式: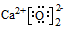 | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 人造纤维、合成纤维和光导纤维都是有机离分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 可用Si2N4、Al2O3制作高温结构陶瓷制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
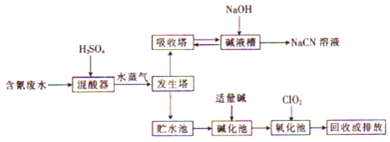
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com