
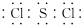 ;
;分析 (1)SCl2是共价化合物,S原子最外层有6个电子,而Cl原子最外层有7个电子,故S原子分别与两个Cl原子以一对共用电子对结合;
(2)在反应SO2+Cl2+SCl2=2SOCl2中,SO2未发生化合价变化,Cl2的化合价由0价变为-1价,SCl2中S的化合价由+2价变为SOCl2中的+4价;
(3)SOCl2和水反应生成的SO2和HCl能分别和HCO3-反应;
(4)①若将AlCl3溶液蒸发至干并充分灼烧,氯化铝会完全水解为氢氧化铝,氢氧化铝在灼烧时会分解为氧化铝,据此分析;
②AlCl3•6H2O中加入SOCl2并加热,SOCl2能和水反应生成HCl气体,从而对氯化铝的水解产生抑制,据此分析;
解答 解:(1)SCl2是共价化合物,S原子最外层有6个电子,而Cl原子最外层有7个电子,故S原子分别与两个Cl原子以一对共用电子对结合,故电子式为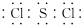 ,故答案为:
,故答案为: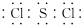 ;
;
(2)在反应SO2+Cl2+SCl2=2SOCl2中,SO2未发生化合价变化,Cl2的化合价由0价变为-1价,SCl2中S的化合价由+2价变为SOCl2中的+4价,故此反应转移2mol电子,生成2molSOCl2,故当生成1molSOCl2时转移1mol电子,故答案为:1;
(3)SOCl2和水反应生成SO2和HCl:SOCl2+H2O=SO2+2HCl,而SO2和HCl能分别和足量的HCO3-反应:SO2+2HCO3-=SO32-+CO2↑+H2O,H++HCO3-=H2O+CO2↑,将三反应相加即可得总反应:SOCl2+4HCO3-=SO32-+2Cl-+4CO2↑+2H2O,故答案为:SOCl2+4HCO3-=SO32-+2Cl-+4CO2↑+2H2O;
(4)①AlCl3溶液中存在Al3+的水解,且加热促进水解,若将AlCl3溶液蒸发会生成Al(OH)3和HCl,随着HCl的挥发,最终得到Al(OH)3,再充分灼烧促进Al(OH)3分解为Al2O3,故答案为:Al2O3;
②SOCl2遇水分解成二氧化硫和氯化氢,则AlCl3•6H2O中加入SOCl2,加热时SOCl2遇水反应,既消耗水可以利用生成的HCl抑制Al3+的水解,可制得无水氯化铝,具体可用方程式Al2O3•6H2O+6SOCl2$\frac{\underline{\;△\;}}{\;}$AlCl3+6SO2↑+12HCl↑表示,
故答案为:AlCl3•6H2O中加入SOCl2,加热时SOCl2遇水反应,既消耗水可以利用生成的HCl抑制Al3+的水解,方程式为Al2O3•6H2O+6SOCl2$\frac{\underline{\;△\;}}{\;}$AlCl3+6SO2↑+12HCl↑.
点评 本题考查了共价化合物的电子式、化学方程式的书写和盐类水解的应用,综合性较强,应注意的是氯化铝是挥发性酸的弱碱盐,故在蒸发结晶时会彻底水解.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,苯与浓硫酸和浓硝酸的混合液生成硝基苯 | |
| B. | 乙烯在催化剂作用下水化成乙醇 | |
| C. | 钠在乙醇中生成乙醇钠 | |
| D. | 水壶中的水垢通常用醋洗去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 3:4 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂不改变反应速率 | B. | 降低压强能加快反应速率 | ||
| C. | 升高温度能加快反应速率 | D. | 改变压强对反应速率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 |
| 向硬水中加入①(填序数),直到不再产生沉淀为止. |
| 继续向溶液中加入③(填序数),直到不再产生沉淀为止. |
| 将上述混合物过滤(填操作) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com