
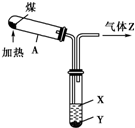
| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |

查看答案和解析>>
科目:高中化学 来源: 题型:
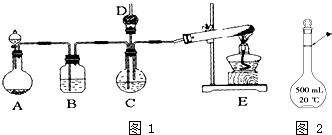 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.查看答案和解析>>
科目:高中化学 来源: 题型:
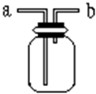 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“水滴石穿”可能的原因是溶解了CO2的雨水与CaCO3作用生成了可溶性Ca(HCO3)2的缘故 |
| B、25℃时,难溶物XY和AB3的Ksp分别为1.0×10-10和2.7×10-15,则该温度下,两者的饱和溶液中c(X+)一定大于c(A3+) |
| C、25℃时,pH=ll的KaA溶液和pH=11的KOH溶液,水电离的c(OH-)前者是后者的108倍 |
| D、不用其它试剂能把NaCl、AlCl3、Ba(OH)2三种溶液鉴别出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
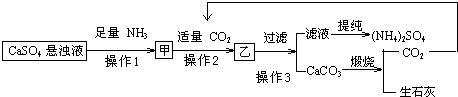
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com