


科目:高中化学 来源: 题型:
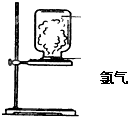 如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
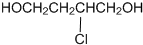
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
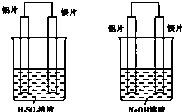 有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:
有甲和乙两位同学均想利用原电池反应来检测金属的活动性顺序,两人都使用镁片和铝片作电极,但甲同学将电极放到6mol?L-1 H2SO4溶液中,乙同学将电极放到6mol?L-1NaOH溶液中,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
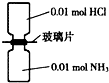 NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01NA个NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com