



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、弱电解质在溶液中部分电离,存在电离平衡 |
| B、在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C、同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同 |
| D、纯净的强电解质在液态时,有的导电,有的不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸盐是氧化剂 |
| B、维C是还原剂 |
| C、Fe2+被亚硝酸盐氧化 |
| D、维C被Fe3+还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
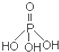 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.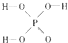 都可以跟重水分子(D2O)中的D原子发生氢交换. 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是
都可以跟重水分子(D2O)中的D原子发生氢交换. 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是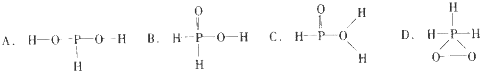
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光照 |
| Br2 |
| NaOH,醇 |
| △ |
| Br2水 |
| NaOH,H2O |
| O2,催化剂 |
| △ |
| O2,催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、300 mL 0.2mol/L的MgCl2溶液 |
| B、200 mL 0.5mol/L的NaCl溶液 |
| C、100 mL 0.1mol/L的FeCl3溶液 |
| D、400 mL 0.3mol/L的CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com