
【题目】化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A.“滴水石穿、绳锯木断”不涉及化学变化
B.明矾净水的原理和“84”消毒液消毒的原理不相同
C.氟利昂作制冷剂会加剧雾霾天气的形成
D.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关非金属元素说法正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.SO2具有氧化性,可用于漂白纸浆
C.液氨汽化时要吸收大量的热,可用作制冷剂
D.硅是重要的半导体材料,常用于制作光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.铅蓄电池是二次电池
B.碱性锌锰电池不是一次电池
C.一般化学电池的活性物质储存在电池内部,限制了电池容量
D.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
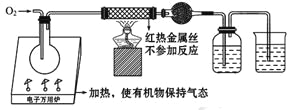
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是: 、______________________、______________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为_______,它可能属于_______(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为: 。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写于下表中:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如右图所示。下列叙述正确的是

A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 “摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500 ℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3 SO2 NH3 H2O
B.FeO SO3 NH3 H2O
C.FeO SO2 NH3 H2O
D.Fe2O3 SO3 SO2 NH3 H2O
根据所学知识,可确定________不成立(填序号)。
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。
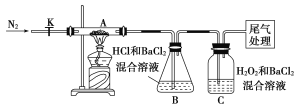
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是____________________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为______________________。
③实验验证:取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______________________。
(4)【实验结论与反思】通过实验现象和认真反思,上述(1)猜想中一定正确的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修物质结构与性质]
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请同答下列问题:
(1)元素W在周期表中的位置是________,XR2的电子式为____。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为___________。Y、W的氢化物沸点高的是_______(写化学式),原因是___________________。
(3)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的同位素![]() ,它的氯化物XCl2 2.22g 溶于水配成溶液后,加入1molL-1的AgNO3 溶液40 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 2.22g 溶于水配成溶液后,加入1molL-1的AgNO3 溶液40 mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)X元素在周期表中的位置是_____________;
(2)写出XCl2的电子式_________________;
(3)把X的单质放入水中,写出反应的化学方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com