
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
 下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
下表是周期表的一部分,表中所列的字母分别代表某一化学元素.| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省惠阳一中实验学校高一下学期3月月考化学试卷(带解析) 题型:填空题
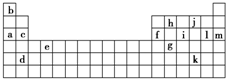
下表是周期表的一部分,表中所列的字母分别代表某一化学元素。
| b | | | |||||||||||||||
| | | | | h | | j | | | |||||||||
| a | c | f | | i | | l | m | ||||||||||
| | | | e | | | | | | | | | | g | | k | | |
| | d | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省泉州一中高二下学期期中考试化学试卷(带解析) 题型:填空题
(9分)下表是周期表的一部分,试回答下列问题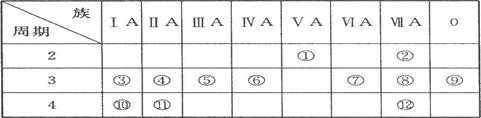
(1)、表中元素中,第一电离能最小的元素是 (填元素符号,下同),电负性最大的元素是 ,单质中化学性质最不活泼的是__________ (填化学式)。
(2)、表中元素的最高价氧化物对应水化物中,酸性最强的是 (填化学式,下同),碱性最强的是 ,呈两性的氢氧化物是 。
(3)、表中ⅦA元素中最不稳定的氢化物是__________(填化学式)。
(4)、为什么表中的④第一电离能比⑤大?
______________________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:推断题
(9分)下表是周期表的一部分,试回答下列问题
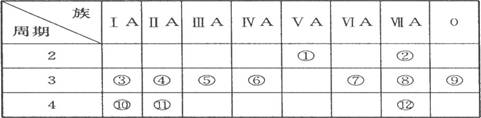
(1)、表中元素中,第一电离能最小的元素是 (填元素符号,下同),电负性最大的元素是 ,单质中化学性质最不活泼的是__________ (填化学式)。
(2)、表中元素的最高价氧化物对应水化物中,酸性最强的是 (填化学式,下同),碱性最强的是 ,呈两性的氢氧化物是 。
(3)、表中ⅦA元素中最不稳定的氢化物是__________(填化学式)。
(4)、为什么表中的④第一电离能比⑤大?
______________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com