
【题目】人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法不正确的是( )
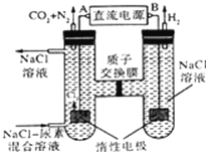
A.B为电源的正极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.电子移动的方向是B→右侧惰性电极,左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
【答案】A
【解析】
根据反应装置可确定为电解池,右边电极H原子得电子化合价降低,发生还原反应,为阴极;左边电极为阳极,阳极室反应为6Cl﹣-6e﹣=3Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,阴极反应式为2H2O+2e﹣=H2↑+2OH﹣,电子从负极流向阴极、阳极流向正极;
A.通过以上分析知,B为电源的负极,A错误;
B.电解过程中,阴极反应式为2H2O+2e﹣=H2↑+2OH﹣,溶液中氢氧根离子浓度增大,溶液的pH增大,所以电解结束后,阴极室溶液的pH与电解前相比将升高,B正确;
C.电子从负极流向阴极、阳极流向正极,所以电子移动的方向是B→右侧惰性电极、左侧惰性电极→A,C正确;
D.通过以上分析知,阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,D正确;
答案为A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应式_______________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3:____________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol·L-1FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变血红;
据②、③、④现象得出的结论是______________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_________________。
Ⅱ.利用如图装置作电解50 mL 0.5 mol·L-1的CuCl2溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①________________;②___________。
(2)分析实验记录B中浅蓝色固体可能是____(写化学式),试分析生成该物质的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析错误的是( )
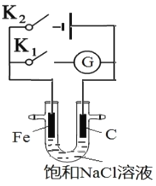
A.闭合K1构成原电池,闭合K2构成电解池
B.K1闭合,铁棒上发生的反应为:Fe﹣2e﹣═Fe2+
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K1闭合,石墨棒周围溶液pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为________
(2)NiO、FeO的晶体结构类型均与氯化钠的相同、Fe2+和Ni2+的离子半径分别78pm和69pm,则熔点FeO________ (填“<”或“>”) NiO;
(3)[Ni(NH3)6]SO4中阴离子的立体构型是_____。氨的沸点____(填“高于”或“低于”)膦(PH3),原因是_________;
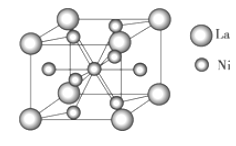
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________;
(5)某镍白铜合金的立方晶胞结构如图所示。
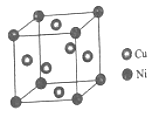
①晶胞中镍原子的堆积模型名称是_____。
②元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______
③若合金的密度为dg/cm3,晶胞参数(即边长)a =________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,试回答下列问题:
Cl2↑+MnCl2+2H2O,试回答下列问题:
(1)该反应中氧化剂与还原剂的物质的量比为:__。
(2)写出该反应的离子方程式:___。
(3)当有0.2mol电子转移时,生成标准状况下Cl2的体积是___L。
(4)若用足量二氧化锰与50ml36.5%1.2g/ml浓盐酸反应,制得的Cl2在标准状况下总小于3.36L,原因可能是①__,②__。
(5)检验氯气是否收集满的方法是用___试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式书写正确的是
A. 乙烯与溴的加成反应: H2C===CH2+Br2 → CH3CHBr2
B. 苯与硝酸的取代反应:![]() +HNO3
+HNO3 ![]() +H2O
+H2O
C. 乙醇与氧气的催化氧化:2CH3CH2OH+O2 ![]() 2CO2+3H2O
2CO2+3H2O
D. 乙醇与乙酸的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入Cl2(溶液体积变化忽略不计),生成I2、Fe3+的物质的量随通入Cl2的物质的量的变化如图所示,下列说法错误的是( )
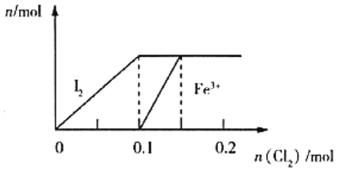
A.还原性强弱:Fe2+<I-
B.n(Cl2)=0.05mol时,溶液中I-的物质的量浓度为0.1mol·L-1
C.若n(Cl2):n(FeI2)=6:5,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
D.n(Cl2)=0.12mol时,溶液中的离子主要有Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是
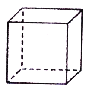
A.立方烷是苯(C6H6)的同系物
B.立方烷一氯代物1种、二氯代物有3种
C.立方烷在空气中可燃,燃烧有黑烟产生
D.立方烷三氯代物和五氯代物种类相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com