
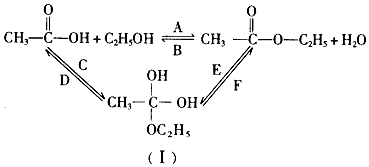
分析 (1)依据题中流程可知,石油分馏可得C8H18,C8H18经裂解得CH2=CH2,CH2=CH2与水发生加成反应得乙醇;
(2)淀粉为多糖,水解生成最终产物为葡萄糖;葡萄糖发酵可生成乙醇和二氧化碳;
(3)A、B均为取代反应,C、E中羰基转化为-OH,则C、E均发生加成反应,D、F中-OH转化为羰基.
解答 解:(1)CH2=CH2与水发生加成反应得乙醇,反应的方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;
(2)淀粉为多糖,水解生成最终产物为葡萄糖,化学方程式为( C6H10O5)n+nH2O$\stackrel{一定条件}{→}$nC6H12O6;淀粉为多糖,水解生成最终产物为葡萄糖,葡萄糖在酒化酶的作用下生成乙醇和二氧化碳,反应方程式为C6H12O6(葡萄糖)$\stackrel{一定条件}{→}$2 CH3CH2OH+2CO2↑,
故答案为:( C6H10O5)n+nH2O$\stackrel{一定条件}{→}$nC6H12O6、C6H12O6(葡萄糖)$\stackrel{一定条件}{→}$2 CH3CH2OH+2CO2↑;
(3)A反应,乙酸中的羟基被CH3CH2O-取代生成乙酸乙酯,该反应属于取代反应;
B中乙酸乙酯水解为A的逆反应,属于取代反应;
C反应,乙酸中碳氧双键打开,与乙醇发生加成,属于加成反应;
E中,乙酸乙酯和水发生加成反应;
F中,一种物质生成两种物质,属于消去反应;
D反应产物乙酸中含有碳氧双键,E反应中生成乙酸乙酯中含有碳氧双键,所以这两反应属于消去反应,
故答案为:A、B;C、E.
点评 本题考查有机物的合成,为高考常见题型,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压,22.4 SO3中的硫原子数目大于NA | |
| B. | 50g质量分数为34%的过氧化氢水溶液中含氧原子数目为NA | |
| C. | 5.6g Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 0.2mol AlCl3中含离子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2NA | |
| B. | 相同物质的量的CO与CO2 含有碳原子数相同 | |
| C. | 标准状况下,14 g氮气含有的核外电子数为7NA | |
| D. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)
,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
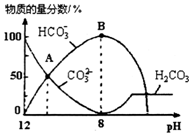 25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )| A. | A点所示溶液的pH<11 | |
| B. | B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | A点→B点发生反应的离子方程式为CO32-+H+═HCO3- | |
| D. | 分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com