
| A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.等物质的量Na2FeO4氧化能力优于次氯酸钠 |
| B.湿法中氢氧化铁被氧化 |
| C.干法中每生成1 mol Na2FeO4转移3 mol电子 |
| D.高铁酸钠的氧化性大于次氯酸钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水在化学反应中既可以作氧化剂,又可以作还原剂 |
| B.1molCl2与足量Fe反应,转移的电子数为3NA |
| C.发生化学反应时失去电子数越多的金属原子,还原能力越强 |
| D.若A2+2D- =2A-+D2,则氧化性:D2>A2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述①、③、⑤属于氧化还原反应,②、④属于非氧化还原反应 |
| B.MoO3是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 蒸馏水 | 淀粉溶液 | KI固体 | 稀KOH溶液 | 一段时间后观察实验现象 |
| 1 | 30mL | 2 mL | 5g | 0滴 | 试管中出现了蓝色 |
| 2 | 29.5 mL | | 5g | 10滴 | 试管中出现了很浅的淡蓝色 |
| 3 | 29 mL | 2 mL | | 20滴 | 试管中无明显变化 |
| 4 | | 2 mL | 5g | 30滴 | |
| 实验方案(不要求写具体过程) | 预期实验结果和结论 |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
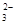 +O2+xOH—
+O2+xOH— +2H2O,
+2H2O,| A.每生成1mol Fe3O4,反应转移的电子总数为3mol ; |
| B.x="6" |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol; |
| D.Fe2+和S2O32—-都是还原剂; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
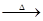 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2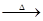 7N2+8CO+4H2O。
7N2+8CO+4H2O。| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4和FeS2是氧化剂,FeS2是还原剂 |
| B.5 mol FeS2发生反应,有21 mol e—转移 |
| C.Cu2S既是氧化产物又是还原产物 |
| D.产物中的SO42-有一部分是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com