
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 (1)根据溶液颜色变化且30S内不变色,可说明达到滴定终点;
(2)实验中应控制流速并观察锥形瓶中颜色变化;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断;
(4)根据酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗;
(5)读数时目光平视,凹液面最低点与刻度线相切;
(6)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求NaOH溶液的物质的量浓度;
解答 解:(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,并且30S内不变色;
故答案为:红;无;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,以判定终点;
故答案为:B;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多,造成V(标准)偏大,根据根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大;
故答案为:待测溶液润洗锥形瓶;偏高;
(4)根据酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗,以防被稀释;
故答案为:用标准液润洗滴定管;
(5)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60mL;
故答案为:22.60;
(6)两次消耗的盐酸标准液的体积为19.90mL,20.00mL,均有效,标准盐酸溶液的平均体积为19.95mL,
HCl~NaOH
1 1
0.1000mol•L-1×19.95mL c(NaOH)×25.00mL
解得:c(NaOH)=0.08mol/L;
故答案为:0.08.
点评 本题主要考查了酸碱中和滴定的操作、误差分析以及有关的化学计算,难度中等,掌握中和滴定的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
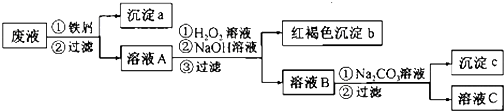
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
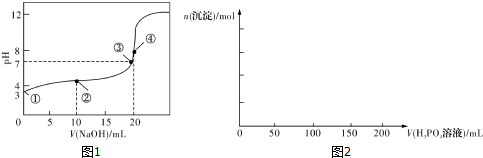
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金刚石>晶体硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
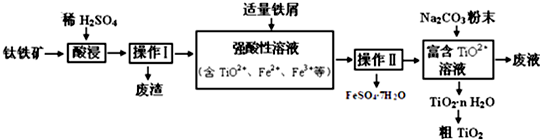
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com